题目内容
【题目】请结合下列实验常用装置,回答有关问题。
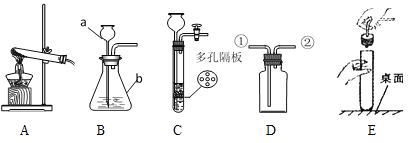
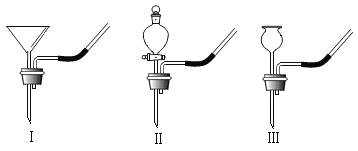
(1)写出图中标有字母的仪器名称:a_________________;b______________。
(2)用氯酸钾和二氧化锰制取氧气,反应的化学方程式是__________________________。某同学采用A装置作发生装置,为保证装置的气密性,采用如图E所示操作,则可能造成的后果之一是______________________。
(3)实验室制取3.2g氧气,理论上需要加热_______________克氯酸钾?(写出计算过程,结果保留整数)
(4)实验室制取CO2的化学方程式是_________________。装置B、C都可以用来制取CO2,比较这两个装置的不同,指出C装置的一个突出优点____________________。
(5)实验室制取H2的化学方程式是______________________。有一名同学欲用D装置收集H2,则H2应从导管口___________通入(填“①”或“②”)。
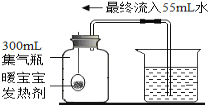
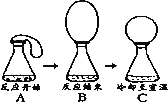
(6)某同学做了一个趣味实验,他把气球中的镁屑加入到盛有稀盐酸的锥形瓶中.整个实验过程如图所示(实验装置的气密性良好),请回答下列问题:B→C过程中产生的现象说明__________________。
【答案】长颈漏斗 锥形瓶 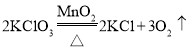 试管破裂 8g CaCO3+2HCl=CaCl2+CO2↑+H2O 控制反应的发生与停止 Zn+H2SO4=ZnSO4+H2↑ ② 反应放热
试管破裂 8g CaCO3+2HCl=CaCl2+CO2↑+H2O 控制反应的发生与停止 Zn+H2SO4=ZnSO4+H2↑ ② 反应放热
【解析】
(1)仪器a是长颈漏斗,b是锥形瓶。
(2)加热氯酸钾和二氧化锰生成氯化钾和氧气,方程式是: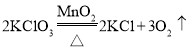 。某同学采用A装置作发生装置,将试管按在桌上,容易使试管破裂。
。某同学采用A装置作发生装置,将试管按在桌上,容易使试管破裂。
(3)设制取3.2g氧气,理论上需要氯酸钾质量为x.
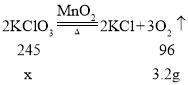
![]()
X≈8g。
(4)大理石与稀盐酸反应生成氯化钙、CO2和水,方程式是:![]() 。装置B、C都可以用来制取CO2, C装置的一个突出优点是控制反应的发生与停止。想停止时就关闭止水夹,试管内气体增多,压强增大,将盐酸压入长颈漏斗,盐酸与大理石分离了,反应停止;当打开止水夹,气体流出,盐酸下落,与大理石接触,反应继续进行。
。装置B、C都可以用来制取CO2, C装置的一个突出优点是控制反应的发生与停止。想停止时就关闭止水夹,试管内气体增多,压强增大,将盐酸压入长颈漏斗,盐酸与大理石分离了,反应停止;当打开止水夹,气体流出,盐酸下落,与大理石接触,反应继续进行。
(5)实验室常用锌与稀硫酸制取H2,还生成硫酸锌,化学方程式是:Zn+H2SO4=ZnSO4+H2↑。若用D装置收集H2,氢气密度比空气小,应从导管口②通入,随气体增多,气体下移,将空气从管①排出。
(6)A→B整个过程中观察到的现象是:固体溶解,有大量气泡产生,气球胀大;②B→C过程中,我们可以观察到气球变小,说明镁与稀盐酸反应放出了热量,冷却后温度降低气球变小。