题目内容
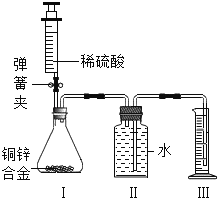
【题目】某同学利用以下实验装置准确测定出某混合气体中(成分:CO、CO2、H2)各组分的质量分数。实验时先通一段时间氮气,再继续实验(已知:3H2 +Fe2O3![]() 2Fe+3H2O.实验中供选用试剂:①NaOH溶液,②澄清石灰水,③浓硫酸。且装置中试剂均足量)。
2Fe+3H2O.实验中供选用试剂:①NaOH溶液,②澄清石灰水,③浓硫酸。且装置中试剂均足量)。
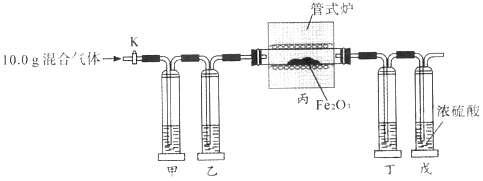
下列说法正确的是( )
A. 甲、乙、丁中依次盛装试剂①、试剂③、试剂②
B. 实验时,应先打开活塞K,再用管式炉加热
C. 装置戊的作用是吸收反应生成的水蒸气
D. 测得装置甲、装置丁反点前后的质量差即可求出各组分的质量分数
【答案】B
【解析】
A. 甲、乙、丁中依次盛装试剂①、试剂③、试剂①,故A错误;
B. 实验时,应先打开活塞K通入氮气或其它性质稳定的保护气排出试管内空气,再进行实验,故B错误;
C. 装置戊的作用是吸收空气中的水蒸气,防止空气中的水蒸气对实验的影响,故C错误;
D.根据装置甲增加的质量就是混合气体中二氧化碳的质量,装置丁增加的质量是生成二氧化碳的质量,进而计算出混合气体中CO的质量,氢气的质量也就能确定,即可求出各组分的质量分数,故D正确;
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】下列归纳和总结完全正确的一组是( )
A.化学反应基本类型 | B.化学反应中常见的“三” |
①化合反应:4P+5O2 ②分解反应:H2CO3═H2O+CO2↑ ③置换反应:3CO+Fe2O3 | ①煤、石油、天然气,三大化石燃料 ②可燃物、氧气、温度达到着火点,燃烧三条件 ③分子、原子、离子,构成物质的三种粒子 |
C.对鉴别方法的认识 | D.化学与生活 |
①区分氮气和氧气:伸入带火星的木条 ②区分棉纤维和羊毛纤维:点燃后闻气味 ③区分硫酸铵和氯化铵:加熟石灰粉末研磨 | ①用甲醛水溶液浸泡水产品防腐 ②缺乏维生素C易患坏血病 ③自行车支架喷油漆防锈 |
A. AB. BC. CD. D
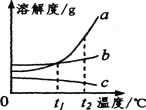
【题目】下表是 KNO3 在不同温度下的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g/100g 水) | 13.3 | 31.6 | 63.9 | x | 169 | 246 |
①表中“63.9”的含义是 ___。
②20℃将 31gKNO3 固体放入 50g 水中,所得溶液的质量是 ___g,若升温到 40℃所得溶液的溶质质量分数是 ___(精确到 0.1%)。
③从硝酸钾溶液中获取晶体的最佳方法是 ___。
④为测定 x 的值,取 4 份 60℃的水各 50g,分别进行实验,并记录数据如下表:
实验编号 | 甲 | 乙 | 丙 | 丁 |
KNO3 的质量/g | 40 | 50 | 60 | 70 |
H2O 质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 90 | 100 | 105 | 105 |
由实验可知 ___。
A 甲所得溶液中溶质质量分数为 80%
B 乙和丙所得溶液溶质质量分数相等
C 丙和丁所得溶液中含溶质质量相等
D 60℃时 KNO3 的溶解度为 110g/100g 水