题目内容
白色粉末M是由Na2CO3和NaHCO3组成的混合物.取甲、乙、丙三份质量不同的M样品分别跟50克相同的稀盐酸充分反应,得到的气体质量与M的质量关系如下表:| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸质量/克 | 50 | 50 | 50 |
| 加入M的质量/克 | 3.80 | 6.20 | 7.20 |
| 生成气体的质量/克 | 1.76 | 2.62 | 2.62 |
【答案】分析:根据表甲和表乙中的数据固体盐酸质量不变,固体质量增加后,气体的质量不变,说明盐酸在乙中是不足或刚好反应的,表甲和表乙中的盐酸都是50g,固体质量增加2.4克,但是气体质量只增加了0.86克,不符合表甲中的气体生成的比例,所以表乙中固体是过量的,需要按照表甲中的数据计算进行分析;
根据碳酸钠、碳酸氢钠和盐酸反应方程式中的比例关系结合固体质量和气体质量列出方程进行分析.
解答:解:从表甲和表乙中的数据固体盐酸质量不变,固体质量增加后,气体的质量不变,说明盐酸在乙中是不足或刚好反应的,表甲和表乙中的盐酸都是50g,固体质量增加2.4克,但是气体质量只增加了0.86克,不符合表甲中的气体生成的比例,所以表乙中固体是过量的,需要按照表甲中的数据计算,
设混合物中碳酸氢钠的质量是x,碳酸氢钠对应的生成二氧化碳的质量是y,则碳酸钠的质量就是(3.8-x),碳酸钠对应的生成二氧化碳的质量是z,
NaHCO3+HCl=NaCl+H20+CO2↑
84 44
x y
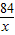 =
=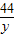
y= g.
g.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
(3.8g-x) z
 =
=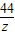
z=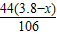
所以二氧化碳的质量为:1.76= +
+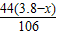
所以碳酸氢钠质量为:x=1.68g,
碳酸钠质量为:3.8-1.68=2.12g,
碳酸钠质量分数为: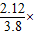 100%=55.8%,
100%=55.8%,
碳酸氢钠质量分数为: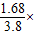 100%=44.2%,
100%=44.2%,
答:Na2CO3的质量分数:55.8%,NaHCO3的质量分数:44.2%.
点评:在解此类题时,首先根据表中的数据,找出采用哪组数据进行计算,然后根据反应方程式中的比例关系和题中的数据列出需要方程进行解答.
根据碳酸钠、碳酸氢钠和盐酸反应方程式中的比例关系结合固体质量和气体质量列出方程进行分析.
解答:解:从表甲和表乙中的数据固体盐酸质量不变,固体质量增加后,气体的质量不变,说明盐酸在乙中是不足或刚好反应的,表甲和表乙中的盐酸都是50g,固体质量增加2.4克,但是气体质量只增加了0.86克,不符合表甲中的气体生成的比例,所以表乙中固体是过量的,需要按照表甲中的数据计算,
设混合物中碳酸氢钠的质量是x,碳酸氢钠对应的生成二氧化碳的质量是y,则碳酸钠的质量就是(3.8-x),碳酸钠对应的生成二氧化碳的质量是z,
NaHCO3+HCl=NaCl+H20+CO2↑
84 44
x y
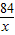 =
=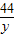
y=
 g.
g.Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
(3.8g-x) z
 =
=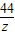
z=
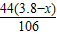
所以二氧化碳的质量为:1.76=
 +
+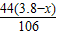
所以碳酸氢钠质量为:x=1.68g,
碳酸钠质量为:3.8-1.68=2.12g,
碳酸钠质量分数为:
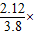 100%=55.8%,
100%=55.8%,碳酸氢钠质量分数为:
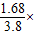 100%=44.2%,
100%=44.2%,答:Na2CO3的质量分数:55.8%,NaHCO3的质量分数:44.2%.
点评:在解此类题时,首先根据表中的数据,找出采用哪组数据进行计算,然后根据反应方程式中的比例关系和题中的数据列出需要方程进行解答.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
白色粉末M是由Na2CO3和NaHCO3组成的混合物.取甲、乙、丙三份质量不同的M样品分别跟50克相同的稀盐酸充分反应,得到的气体质量与M的质量关系如下表:
试计算M中Na2CO3和NaHCO3的质量分数各是多少?
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸质量/克 | 50 | 50 | 50 |
| 加入M的质量/克 | 3.80 | 6.20 | 7.20 |
| 生成气体的质量/克 | 1.76 | 2.62 | 2.62 |
白色粉末M是由Na2CO3和NaHCO3组成的混合物.取甲、乙、丙三份质量不同的M样品分别跟50克相同的稀盐酸充分反应,得到的气体质量与M的质量关系如下表:
试计算M中Na2CO3和NaHCO3的质量分数各是多少?
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸质量/克 | 50 | 50 | 50 |
| 加入M的质量/克 | 3.80 | 6.20 | 7.20 |
| 生成气体的质量/克 | 1.76 | 2.62 | 2.62 |
白色粉末M是由Na2CO3和NaHCO3组成的混合物.取甲、乙、丙三份质量不同的M样品分别跟50克相同的稀盐酸充分反应,得到的气体质量与M的质量关系如下表:
试计算M中Na2CO3和NaHCO3的质量分数各是多少?
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸质量/克 | 50 | 50 | 50 |
| 加入M的质量/克 | 3.80 | 6.20 | 7.20 |
| 生成气体的质量/克 | 1.76 | 2.62 | 2.62 |