题目内容
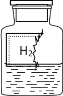
【题目】某化学兴趣小组,利用如图所示装置进行实验,在甲乙两只完全相同的试管中,装有质量和质量分数均相同的稀盐酸,在两只试管上方各罩一个完全相同的气球,两个气球中分别装有相同质量的金属粉末A和B,现同时提起两个球,使其中的金属粉末迅速与稀盐酸反应。
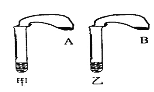
(1)通过两支气球_________________________的现象,可比较出金属A、B的活动性强弱。
(2)此实验设计的特点是__________________________;
(3)如果在上述实验中,金属A是锌粉,金属B是镁粉,实验结束后,甲试管中无固体剩余,乙试管中仍由少量固体。将两支试管中剩余物全部导入废液缸中,充分混合后固体消失。(注:金属氧化物与酸反应不生成气体)
(提出问题)废液中含有哪些溶质呢?
(猜想与假设)
猜想1:MgCl2 ZnCl2
猜想2:MgCl2 HCl
猜想3:MgCl2 ZnCl2 HCl
(表达与交流)写出猜想1的理由是_________________________
(反思与评价):请对猜想2做出评价_______________________
【答案】鼓起的快慢装置简便、现象明显镁和盐酸反应生成氯化镁和氢气,锌和盐酸反应生成氯化锌和氢气,甲试管中无固体剩余,说明两者恰好完全反应或盐酸剩余,乙试管中镁片过剩,将两试管中剩余物都倒入废液缸中,充分混合后固体消失,废液缸溶液中没有任何不溶物,剩余少量的镁可以和盐酸、氯化锌反应,所以废液缸中一定含有MgCl2、ZnCl2错误
【解析】
(1)金属与酸反应生成氢气的快慢可以判断其活动性强弱,此实验可以通过观察气球鼓起的快慢,来比较出金属A、B的活动性强弱;
(2)此实验装置具有:装置简便、现象明显等特点;
(3)表达与交流:镁和盐酸反应生成氯化镁和氢气,锌和盐酸反应生成氯化锌和氢气,甲试管中无固体剩余,说明两者恰好完全反应或盐酸剩余,乙试管中镁片过剩,将两试管中剩余物都倒入废液缸中,充分混合后固体消失,废液缸溶液中没有任何不溶物,剩余少量的镁可以和盐酸、氯化锌反应,所以废液缸中一定含有MgCl2、ZnCl2;
反思与评价:两试管中溶液混合后,废液缸溶液中没有任何不溶物,说明乙试管中过剩的镁被甲试管中的过剩的盐酸反应完,而甲试管中的氯化锌不反应,废液中一定有氯化锌,而猜想中没有,所以错。