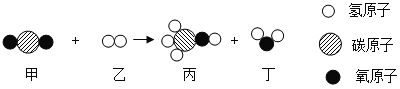
题目内容
【题目】图甲是小明在 20℃时进行的系列实验示意图,①-⑤表示实验所得溶液;图乙是 NaCl,KNO3的溶解度曲线(计算均保留一位小数)。
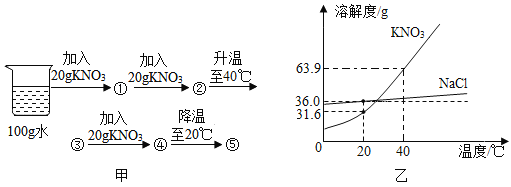
(1)图甲中①溶液的溶质质量分数=__________;①-⑤中属于饱和溶液的是___________;④→⑤的过程中析出 KNO3 晶体__________g。
(2)40℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和 KNO3溶液中溶质的质量分数(w2)的大小关系是:w1_________w2 (填“>”、“=”或“<”)。
(3)除去KNO3 固体中混有的少量 NaCl 的实验操作是:加适量水溶解→加热得到热饱和溶液→_________→过滤→洗涤→干燥→KNO3 晶体。
【答案】16.7% ②⑤ 28.4 < 降温结晶
【解析】
(1)图甲中①溶液中的溶剂质量为100g,溶质KNO3的质量为20g,溶质质量分数=![]() ,20℃时硝酸钾的溶解度为31.6g,即在,20℃时100g水中最多能溶解31.6g硝酸钾,①中100g水中加入了20g硝酸钾所以①是不饱和溶液,②中100g水中加入了40g硝酸钾所以②是饱和溶液,40℃时硝酸钾的溶解度为63.9g,即在,40℃时100g水中最多能溶解63.9g硝酸钾,所以③④是不饱和溶液,⑤为20℃时的溶液,此温度下100g水中最多能溶解31.6g硝酸钾,而前面一共加入60g硝酸钾,所以会有60g-31.6g=28.4g硝酸钾析出。故填:16.7%;②⑤;28.4。
,20℃时硝酸钾的溶解度为31.6g,即在,20℃时100g水中最多能溶解31.6g硝酸钾,①中100g水中加入了20g硝酸钾所以①是不饱和溶液,②中100g水中加入了40g硝酸钾所以②是饱和溶液,40℃时硝酸钾的溶解度为63.9g,即在,40℃时100g水中最多能溶解63.9g硝酸钾,所以③④是不饱和溶液,⑤为20℃时的溶液,此温度下100g水中最多能溶解31.6g硝酸钾,而前面一共加入60g硝酸钾,所以会有60g-31.6g=28.4g硝酸钾析出。故填:16.7%;②⑤;28.4。
(2)40℃时,氯化钠的溶解度小于硝酸钾的溶解度,所以饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1<w2,故填:<。
(3)硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→降温结晶→过滤→洗涤→干燥→KNO3。故填:降温结晶。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】MgSO47H2O 是一种重要的化工原料,某工厂以一种镁矿石(主要成分为 SiO2和 MgCO3,还含有少量 FeCO3,其它成分忽略)为原料制备 MgSO47H2O 的主要流程如图:
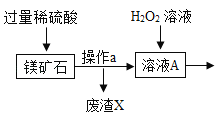
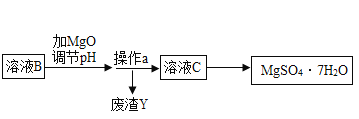
查阅资料:①SiO2既不溶于水也不溶于稀硫酸。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的 pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的 pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:
(1)MgCO3与稀硫酸发生反应的化学方程式为_________;为了让镁矿石与稀硫酸充分反应,提高原料利用率,可采取的措施为_____(填字母)。
A 将镁矿石粉碎 B 升高反应温度 C 用稀硫酸多次浸泡
(2)溶液 A中所含的溶质成分有_____;溶液 A中加入 H2O2溶液会生成 Fe2(SO4)3,该反应的化学方程式为_________。
(3)选用MgO调节pH使 Fe3+转化为沉淀,而不选用NaOH的原因是_____。加氧化镁调节后溶液的 pH范围是____ (用不等式表示)
(4)溶液C经加热浓缩、降温结晶、过滤、洗涤、低温干燥后得到 MgSO47H2O 晶体,低温干燥的目的是_____。