题目内容
【题目】如图是A、B、C三种物质的溶解度曲线,下列分析正确的是________
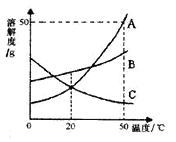
A.三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入50g水中能得到A的饱和溶液,该饱和溶液中溶质与溶剂的质量比为1:1
C.50℃时,配制等质量的A、B、C三种物质的饱和溶液,所需溶剂质量最小的是A物质
D.将50℃的A、B、C三种物质的饱和溶液降温至20℃时,三种溶液中溶质质量分数由大到小顺序为___________
【答案】 C B>A>C
【解析】A.根据物质的溶解度分析解答;
B.根据饱和溶液溶质与溶液的质量比解答;
C.根据物质的溶解度分析解答;
D.根据饱和溶液溶质质量分数解答。
解:A.物质的溶解度受温度的影响,温度不同,溶解度不同。故错误;
B.50℃时,A物质的溶解度是50g。即100g水中最多溶解50gA物质。50g水中最多溶解25gA物质得到饱和。此时该饱和溶液中溶质与溶剂的质量比为25:(25+50=1:3。故错误;
C.50℃时,A、B、C三种物质的溶解度由大到小的顺序是A>B>C。即等质量的水能溶解的溶质质量为A>B>C。故配制等质量的A、B、C三种物质的饱和溶液,所需溶剂质量最小的是A物质。正确;
D.据图可知:A、B的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小;所以将50℃时A、B、C三种物质的饱和溶液均降温到20℃时,A、B析出晶体,依然是饱和溶液,据饱和时质量分数的计算式![]() ×100%,可知溶解度越大质量分数也就越大,20℃时A、B溶液中溶质质量分数大小关系是B>A。C物质溶解度增大,溶质质量分数不变,据饱和时质量分数的计算式
×100%,可知溶解度越大质量分数也就越大,20℃时A、B溶液中溶质质量分数大小关系是B>A。C物质溶解度增大,溶质质量分数不变,据饱和时质量分数的计算式![]() ×100%,可知溶解度越大质量分数也就越大,20℃时A、C溶液中溶质质量分数大小关系是A>C。故将50℃的A、B、C三种物质的饱和溶液降温至20℃时,三种溶液中溶质质量分数由大到小顺序为B>A>C。
×100%,可知溶解度越大质量分数也就越大,20℃时A、C溶液中溶质质量分数大小关系是A>C。故将50℃的A、B、C三种物质的饱和溶液降温至20℃时,三种溶液中溶质质量分数由大到小顺序为B>A>C。

 教学练新同步练习系列答案
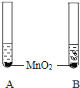
教学练新同步练习系列答案【题目】被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的过氧化氢(H2O2),通常情况下均为无色液体。在化学实验中都有很重要的作用。
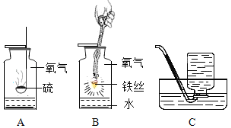
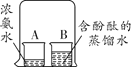
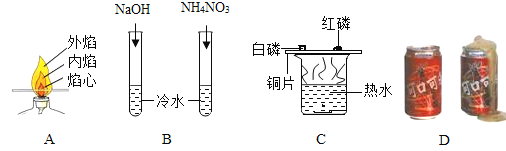
(1)指出下列实验容器中水的主要作用
A:____ B:____ C:_____
(2)鉴别水和过氧化氢两瓶无色液体,请填写有关内容:
实验步骤 | 实验现象 | 实验结论 |
1.将等体积的两种无色液体分别加入A、B两个试管中。 2.分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象。 | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是_____; |
(3)探究影响过氧化氢分解速率的因素?(以下实验中使用的溶液都是过氧化氢溶液)
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 |
1、取一支试管加入5g克5%的溶液,然后加入1g二氧化锰。 | 缓慢有少量气泡冒出 |
2、另取一支试管加入___克 15%的溶液,再加入1g二氧化锰。 | 迅速有大量气泡冒出 |
为保证探究结果的准确性,实验步骤2的横线上的数字是____,通过实验发现:当其他条件相同时,过氧化氢的浓度越高,分解的速率_____。
探究实验二:
序 号 | 溶液 浓度 | 溶液质量/g | 温度/℃ | 收集的氧气体积/ml | 反应时间/S |
1 | 30% | 12 | 40 | 125 | 148 |
2 | 30% | 12 | 90 | 125 | 82 |
此实验的目的是探究____ 对过氧化氢分解速率的影响。