题目内容
O2和CO的混合气体50g,充分燃烧后,将生成的二氧化碳全部吸收,测得剩余气体的质量为6g,此混合气体中CO和O2的质量比可能是
- A.7:4
- B.8:17
- C.7:8
- D.14:11
D
分析:根据质量守恒定律,先计算出生成二氧化碳的质量,然后根据O2和CO反应的化学方程式和二氧化碳的质量,列出比例式,计算出实际参与反应的氧气质量.然后分两种情况考虑:①剩余气体为氧气,②剩余气体为氢气.
解答:根据质量守恒定律,生成二氧化碳的质量为:50g-6g=44g;
设实际参与反应的氧气质量为x,
2CO+O2 2CO2
2CO2
32 88
x 44g
∴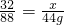 ,
,
解之得:x=16g,
①若剩余气体为氧气,则此混合气体中O2质量为:16g+6g=22g,CO的质量为:50g-22g=28g,CO和O2的质量比为:28g:22g=14:11;
故D正确;
②若剩余气体为氢气,则此混合气体中O2质量为:16g,CO的质量为:50g-16g=34g,CO和O2的质量比为:34g:16g=17:8.选项中没有此项.
故选D.
点评:本题主要考查学生运用化学方程式进行计算的能力.学生需认真分析题意,全面考虑可能出现的情况,才能正确解答.
分析:根据质量守恒定律,先计算出生成二氧化碳的质量,然后根据O2和CO反应的化学方程式和二氧化碳的质量,列出比例式,计算出实际参与反应的氧气质量.然后分两种情况考虑:①剩余气体为氧气,②剩余气体为氢气.
解答:根据质量守恒定律,生成二氧化碳的质量为:50g-6g=44g;
设实际参与反应的氧气质量为x,
2CO+O2
 2CO2
2CO232 88
x 44g
∴
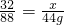 ,
,解之得:x=16g,
①若剩余气体为氧气,则此混合气体中O2质量为:16g+6g=22g,CO的质量为:50g-22g=28g,CO和O2的质量比为:28g:22g=14:11;
故D正确;
②若剩余气体为氢气,则此混合气体中O2质量为:16g,CO的质量为:50g-16g=34g,CO和O2的质量比为:34g:16g=17:8.选项中没有此项.
故选D.
点评:本题主要考查学生运用化学方程式进行计算的能力.学生需认真分析题意,全面考虑可能出现的情况,才能正确解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
O2和CO的混合气体50g,充分燃烧后,将生成的二氧化碳全部吸收,测得剩余气体的质量为6g,此混合气体中CO和O2的质量比可能是( )
| A、7:4 | B、8:17 | C、7:8 | D、14:11 |