题目内容
(2012?佛山)某学习小组围绕“气体实验室制取”进行了研讨.请你参与完成下面的问题.

(1)原理分析:实验室制取CO2的化学方程式为
(2)发生装置:图①装置中仪器a的名称是
(3)收集装置:实验室收集NH3应采用的方法是
(4)实验操作:用KMnO4制取O2的操作过程可概括为“组装仪器→
(5)实验反思:在加热KClO3制O2的过程中,发现产生O2的速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是

(1)原理分析:实验室制取CO2的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.不用Na2CO3与盐酸反应制取CO2的原因是反应快,不易控制
反应快,不易控制
.(2)发生装置:图①装置中仪器a的名称是
锥形瓶
锥形瓶
.实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图②
②
(填序号)发生装置.(3)收集装置:实验室收集NH3应采用的方法是
向下排空气法
向下排空气法
.收集有毒气体SO2时,常采用③收集装置,气体应从c
c
(填字母)端通入.(4)实验操作:用KMnO4制取O2的操作过程可概括为“组装仪器→
检查气密性
检查气密性
→装入药品
装入药品
→固定试管→收集气体→停止加热”.(5)实验反思:在加热KClO3制O2的过程中,发现产生O2的速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是
未加MnO2(或未加催化剂)
未加MnO2(或未加催化剂)
.分析:(1)实验室制取二氧化碳用大理石和稀盐酸反应生成氯化钙、水和二氧化碳;根据碳酸钠与盐酸反应的速率及收集的难易程度分析;
(2)熟练掌握常见的化学仪器及用途;根据反应物的状态和反应条件选择发生装置;(3)根据氨气的密度及溶解性选择收集方法;根据二氧化硫的密度选择收集方法;
(4)根据制取气体的步骤回答;
(5)氯酸钾分解制取氧气需要二氧化锰做催化剂,加快反应的进行.
(2)熟练掌握常见的化学仪器及用途;根据反应物的状态和反应条件选择发生装置;(3)根据氨气的密度及溶解性选择收集方法;根据二氧化硫的密度选择收集方法;
(4)根据制取气体的步骤回答;
(5)氯酸钾分解制取氧气需要二氧化锰做催化剂,加快反应的进行.
解答:解:(1)大理石和稀盐酸反应生成氯化钙、水和二氧化碳,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;因为碳酸钠与盐酸反应的速度很快,不易控制,所以来不及收集;
(2)①是锥形瓶;实验室用无水醋酸钠固体与碱石灰在加热的情况下制CH4,故选择的发生装置属于固固加热型②;
(3)因为氨气易溶于水,密度比空气小(相对分子质量17<29),故采用向下排空气法收集;二氧化硫的密度比空气大,故从长管(c)通入,把空气从短管排出;
(4)制取氧气的步骤是组装好仪器后,要检查装置的气密性,再加入药品,然后固定、收集、停止加热;
(5)氯酸钾在二氧化锰做催化剂的情况下可以加快反应的速率,所以发现产生氧气的速率很慢,可能是未加二氧化锰.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应快,不易控制 (2)锥形瓶 ②
(3)向下排空气法 c (4)检查气密性 装入药品 (5)未加MnO2(或未加催化剂)
(2)①是锥形瓶;实验室用无水醋酸钠固体与碱石灰在加热的情况下制CH4,故选择的发生装置属于固固加热型②;
(3)因为氨气易溶于水,密度比空气小(相对分子质量17<29),故采用向下排空气法收集;二氧化硫的密度比空气大,故从长管(c)通入,把空气从短管排出;
(4)制取氧气的步骤是组装好仪器后,要检查装置的气密性,再加入药品,然后固定、收集、停止加热;
(5)氯酸钾在二氧化锰做催化剂的情况下可以加快反应的速率,所以发现产生氧气的速率很慢,可能是未加二氧化锰.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应快,不易控制 (2)锥形瓶 ②
(3)向下排空气法 c (4)检查气密性 装入药品 (5)未加MnO2(或未加催化剂)
点评:本题考查了气体的制取、收集、实验步骤等,是中考常考的内容,只要根据已有的知识即可解决.

练习册系列答案
相关题目
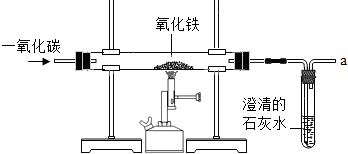 (2012?佛山)炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图:
(2012?佛山)炼铁的原理是利用一氧化碳与氧化铁反应,某同学利用该原理设计了一个实验,实验装置见图: