题目内容
【题目】(5分)高纯碳酸钙广泛应用医药、生活和生产中。由工业副产品氯化钙(含有氯化亚铁和氯化镁)制取高纯碳酸钙的流程如图1。
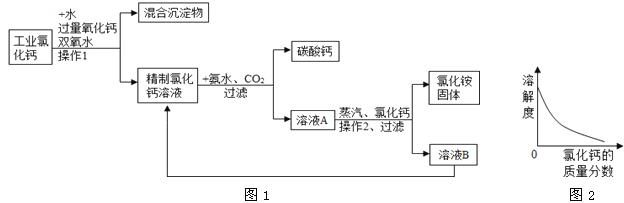
【查阅资料】①氯化铵受热会分解。
②室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图2。
请回答下列问题:
(1)若在实验室完成操作1所需要的玻璃仪器有玻璃棒、烧杯和 。
(2)氯化钙、氨气、二氧化碳和水制取碳酸钙,同时产生NH4Cl的反应化学方程式为 。
(3)溶液B中的溶质是 。
(4)溶液A经蒸发浓缩、操作2、加入氯化钙、过滤等过程方可获得氯化铵固体,操作2的名称是 ,加入适量氯化钙使得氯化铵的溶解度 (填“增大”、“减小”或“不变”)。
【答案】(1)漏斗
(2)CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl
(3)CaCl2 和NH4Cl
(4)降温结晶(冷却热饱和溶液) 减小
【解析】
试题分析:实验室操作1是过滤,所需要的玻璃仪器有玻璃棒、烧杯和漏斗,由B可以制的氯化钙溶液,所以B中一定有氯化钙,同时还有氯化铵。操作2目的是得到大量的氯化铵固体所以操作应该是降温,来结晶得到固体物质,加入适量氯化钙使得氯化铵的溶解度减小。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目