题目内容
【题目】在研究某石灰石样品(杂质不溶于水也不与盐酸反应)的活动中,兴趣小组同学进行了如下实验,过程如图所示: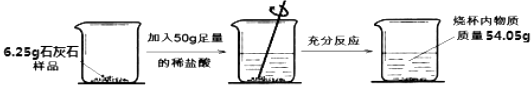
求:
(1)反应中生成二氧化碳的质量是。
(2)该大理石样品中碳酸钙的质量分数是。
(3)100kg这种石灰石充分煅烧后,可得到固体多少kg?(碳酸钙高温分解时只生成氧化钙与二氧化碳)
【答案】
(1)2.2g
(2)80%
(3)解:设生成二氧化碳的质量为x
CaCO3 | CaCO3 |
100 | 44 |
100kg×80% | x |
![]()
x=35.2kg
可得固体的质量为:100kg-35.2kg=64.8kg
答:100kg这种石灰石充分煅烧后,可得固体64.8kg。
【解析】(1)反应中生成二氧化碳的质量是∶6.25g+50g-54.05g=2.2g.
⑵解∶设该大理石样品中碳酸钙的质量为xg
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 2.2g |
![]()
得x=5g.
该大理石样品中碳酸钙的质量分数是 ![]() ×100%=80%.
×100%=80%.
【考点精析】掌握质量守恒定律及其应用和根据化学反应方程式的计算是解答本题的根本,需要知道①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;各物质间质量比=系数×相对分子质量之比.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目