题目内容
【题目】水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)水(“属于”或“不属于”)人类所需的六大基本营养素之一。写出一个反应生成水又属于化合反应的化学方程式:。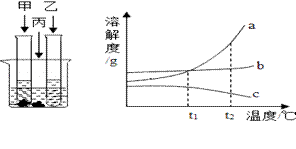
(2)在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如上图所示,甲、丙还有剩余固体,乙固体全部溶解。升温到80℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化。
室温时,(填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。
如图中能表示乙物质的溶解度曲线的是(填“a”、“b”或“c”)。
t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中溶质质量分数由大到小的顺序是 。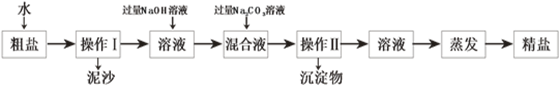
(3)粗盐提纯过程如图,操作I中要用到的玻璃仪器有烧杯、玻璃棒和。某同学所得精盐比其他同学明显要少,原因可能是。
A.溶解时将粗盐一次全部倒入水中,立即过滤 B.提纯后所得精盐尚未完全干燥
【答案】
(1)属于,2H2+O2![]() 2H2O
2H2O
(2)乙,c,甲>丙>乙
(3)漏斗,A
【解析】解:(1) 六大营养素是水、无机盐糖类、油脂、蛋白质、维生素 ; 氢气燃烧生成水,属于由两种物质生成一种物质的化合反应。2H2+O2 ![]() 2H2O ;(2)饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。 由图中信息可知乙溶液可能是不饱和溶液;升温到80℃时,乙固体析出说明乙的溶解度随温度升高而减小,与曲线c相符。发现甲固体全部溶解,说明甲的溶解度随温度升高而变大,与A相符。丙固体没有明显变化,说明丙的溶解度受温度影响较小,为b; 饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% ;t2℃时,甲、乙、丙三种物质的溶解度甲>丙>乙,饱和溶液中溶质质量分数由大到小的顺序是甲>丙>乙 ;(3)过滤操作用到的玻璃仪器有漏斗、烧杯、玻璃棒 ;A、溶解时将粗盐一次全部倒入水中,立即过滤,导致部分食盐为溶解,以滤渣的形式,被丢弃,导致得到精盐量偏少,B、提纯后所得精盐尚未完全干燥,称得精盐量比实际量多。
2H2O ;(2)饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。 由图中信息可知乙溶液可能是不饱和溶液;升温到80℃时,乙固体析出说明乙的溶解度随温度升高而减小,与曲线c相符。发现甲固体全部溶解,说明甲的溶解度随温度升高而变大,与A相符。丙固体没有明显变化,说明丙的溶解度受温度影响较小,为b; 饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% ;t2℃时,甲、乙、丙三种物质的溶解度甲>丙>乙,饱和溶液中溶质质量分数由大到小的顺序是甲>丙>乙 ;(3)过滤操作用到的玻璃仪器有漏斗、烧杯、玻璃棒 ;A、溶解时将粗盐一次全部倒入水中,立即过滤,导致部分食盐为溶解,以滤渣的形式,被丢弃,导致得到精盐量偏少,B、提纯后所得精盐尚未完全干燥,称得精盐量比实际量多。
所以答案是:(1)属于;2H2+O2![]() 2H2O;(2)乙;c;甲>丙>乙;(3)漏斗;A。
2H2O;(2)乙;c;甲>丙>乙;(3)漏斗;A。
【考点精析】关于本题考查的过滤操作的注意事项和饱和溶液和不饱和溶液,需要了解过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解才能得出正确答案.

【题目】甲组同学往20克10%的氢氧化钠溶液样品中滴加10% 的盐酸(室温下)。
下图描述的是氢氧化钠与盐酸反应的微观实质。
(1)从分类角度:氢氧化钠属于。
A.氧化物
B.酸
C.碱
D.盐
(2)从宏观与微观角度:
请从微观的角度分析,甲、乙处应填入的化学符号依次是、。
请用离子符号表示酸碱中和反应的本质:。
判断在盐酸溶液中一定能大量共存的离子组是()
A、Na+、K+、CO32- B、Ag+、NO3-、SO42-
C、Cu2+、NO3-、OH- D、K+、NH4+、SO42-
(3)从能量角度,反应中溶液温度的变化 记录如表,据表数据分析:
加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
溶液温度上升(△t)/℃ | 5.6 | 12.1 | 18.5 | 15.2 | 13.5 |
①当加入盐酸体积为mL时,表明NaOH与HCl恰好完全反应。>此判断的依据是。
②当加入4mL盐酸时,烧杯中溶液仍然呈红色,该溶液中含有的溶质有酚酞和(写化学式)