题目内容
用20吨含Na2CO3 60%的天然碱与消石灰反应来制取火碱,在生产过程中损失Na2CO3 1%,试计算能生产98%的火碱多少吨?
分析:
(1)20吨天然碱中含纯Na2CO3的质量可求:
20吨×60% = 12吨
(2)由于实际生产中损失了1%的Na2CO3,实际用于生产即参加反应的Na2CO3的质量为:
12吨-12吨×1% = 11.88吨
因此可求生产出来的纯NaOH的质量。
解:设可生产纯NaOH的质量为x
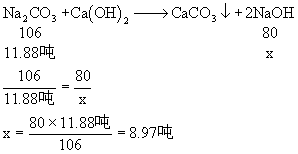
∴可得98%的火碱:
8.97吨÷98%=9.15吨
答:略

练习册系列答案
相关题目