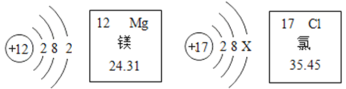
题目内容
甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是

A. t1℃时,甲、乙的饱和溶液中所含溶质质量相等
B. t2℃时,将50g甲加入50g水中,可得到100g溶液
C. 甲中含有少量乙时,可用降温结晶法提纯甲
D. t1℃时,分别将甲、乙的饱和溶液升温至t2℃(水分不蒸发),所得溶液的溶质质量分数:甲>乙
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案兴趣小组同学发现镁条在空气中久置表面会变黑,同学们对镁条变黑的条件及生成物进行了相关的探究。

(一)镁条变黑条件的探究
(查阅资料)常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
(猜想与假设)常温下,镁条变黑可能与O2、CO2、水蒸气有关。
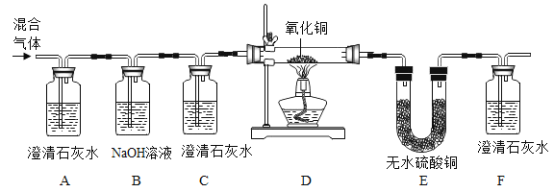
(进行实验)通过控制与镁条接触的物质,利用如图装置(镁条长度为3cm,试管容积20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸再通入约4mLCO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水再通入约4mLCO2 | 镁条第3天开始变黑至20天全部变黑 |
(解释与结论)
(1)实验1和2中,NaOH浓溶液的作用是_____(用化学方程式表示)。
(2)实验3中,试管内的气体主要含有CO2、_____。
(3)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是_____(填编号)。
(4)根据上述实验,兴趣小组同学得出结论:镁条表面黑色物质的形成与_____有关。
(反思与评价)
(5)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是_____。
(二)对镁条变黑后生成物的探究
兴趣小组同学查阅资料,了解到镁条表面的黑色物质是一种混合物,其中主要成分碱式碳酸镁可表示为a Mg(OH)2·b MgCO3·c H2O。
(查阅资料)①Mg(OH)2、MgCO3受热易分解,各生成对应的两种氧化物;
②碱石灰是CaO和NaOH的固体混合物。
(进行实验)兴趣小组同学为进一步确定碱式碳酸镁组成,称取购买的碱式碳酸镁固体18.2g;装入硬质玻璃管,按如下图所示装置进行实验(假设装置A、C、D中所装药品均足量)。
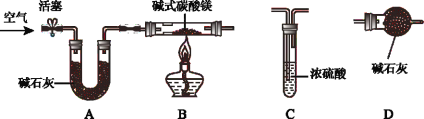
步骤一:连接A和B,打开活塞,通入空气;
步骤二:点燃酒精灯,依次连接装置A→B→_____→_____(填“C”,“D”);
步骤三:待装置B中固体完全反应后,停止加热,继续通入空气,直至冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 | |
C:试管和所盛溶液 | 45.0g | 48.6g |
D:干燥管和固体 | 75.8g | 82.4g |
(解释与结论)
(1)“步骤三”中,当反应结束后,继续通入空气的目的是_____(写一条)。
(2)假设上述数据均准确,通过计算可得:该碱式碳酸镁中a:b:c=_____。
(3)有同学提出,在“步骤二”连接装置的最末端应再接一套装有碱石灰的装置,这样改进的目的是_____。


 稀释浓硫酸 B.
稀释浓硫酸 B.  过滤
过滤 连接仪器 D.
连接仪器 D.  称量氯化钠固体
称量氯化钠固体