题目内容
【题目】某废水中含有AgNO3、Ca(NO3)2、Fe(NO3)2、Cu(NO3)2、NaNO3几种物质,为了回收金属,同时得到较纯的硝酸钠,并保护环境,化学小组的同学设计了一个处理该废水的实验方案,流程如下:
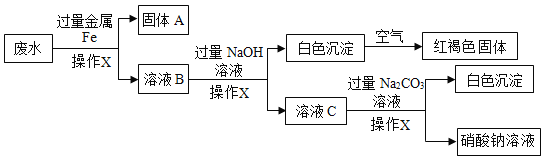
[查阅资料]白色的Fe(OH)2沉淀在潮湿空气中会迅速转化为红褐色的Fe(OH)3。
(1)操作X的名称是__________________;
(2)操作中加入过量金属Fe可以除去废水中的___________和__________,用铁粉末比铁片更好,其原因是___________;
(3)溶液C中含有的阴离子有__________________;
(4)化学兴趣小组对以上流程得到的NaNO3溶液进行检测,分析后可知得到的NaNO3溶液不纯,含有杂质,则最后得到的NaNO3溶液所含的杂质有__________________;
【答案】过滤 AgNO3 Cu(NO3)2 (两空答案互换亦得分) 增大反应物接触面积,反应充分 ![]() 、OH- Na2CO3、NaOH
、OH- Na2CO3、NaOH
【解析】
(1)操作X是将混合物分离得到固体和液体,故操作X是过滤;
(2)铁的活动性比铜和银强,可将铜、银从它们的盐溶液中置换出来,所以加入过量的金属铁可除去废水中的AgNO3、Cu(NO3)2;铁粉的优点是增大反应物接触面积,反应充分;
(3)溶液B中的溶质是硝酸亚铁、硝酸钠、硝酸钙,加入过量的氢氧化钠后,硝酸亚铁转化为氢氧化亚铁,所以溶液C中含有的溶质是硝酸钠、硝酸钙、氢氧化钠,对应的阴离子是硝酸根离子和氢氧根离子,故填:![]() 、OH-;
、OH-;
(4)由于加入的氢氧化钠和碳酸钠均过量,后续操作中对过量的氢氧化钠和碳酸钠未进行处理,所以最后得到的NaNO3溶液所含的杂质有Na2CO3、NaOH。

练习册系列答案
相关题目