题目内容
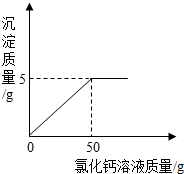
 现称取变质的氢氧化钠样品l0g,配制成溶液,再向其中逐滴加入CaCl2溶液.CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:
现称取变质的氢氧化钠样品l0g,配制成溶液,再向其中逐滴加入CaCl2溶液.CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数.
分析:(1)变质的氢氧化钠含有碳酸钠,与氯化钙反应会生成碳酸钙沉淀,由图象知加入50g氯化钙溶液碳酸钠正好完全反应,生成碳酸钙质量是5g,从而可求氢氧化钠的质量.
(2)利用碳酸钙的质量可求氯化钙的质量,进而求出氯化钙的质量分数.
(2)利用碳酸钙的质量可求氯化钙的质量,进而求出氯化钙的质量分数.
解答:解:(1)变质的氢氧化钠固体中常含有碳酸钠,碳酸钠与氯化钙反应会生成碳酸钙沉淀,由图象知加入50g氯化钙溶液与碳酸钠正好完全反应,生成碳酸钙质量是5g,从而可求氢氧化钠的质量.
设样品中碳酸钠的质量为x,加入的氯化钙溶液中的溶质质量为y.
Na2C03+CaCl2=CaC03↓+2NaCl
106 111 100
x y 5g
=
x=5.3g
=
y=5.55g
该样品中NaOH的质量为l0g-5.3g=4.7g
(2)所加CaCl2溶液的溶质质量分数=
×l00%=11.1%
答:(1)样品中NaOH的质量为4.7g;(2)所加CaCl2溶液的溶质质量分数为ll.1%.
设样品中碳酸钠的质量为x,加入的氯化钙溶液中的溶质质量为y.
Na2C03+CaCl2=CaC03↓+2NaCl
106 111 100
x y 5g
| 106 |
| x |
| 100 |
| 5g |
x=5.3g
| 111 |
| y |
| 100 |
| 5g |
y=5.55g
该样品中NaOH的质量为l0g-5.3g=4.7g
(2)所加CaCl2溶液的溶质质量分数=
| 5.55g |
| 50g |
答:(1)样品中NaOH的质量为4.7g;(2)所加CaCl2溶液的溶质质量分数为ll.1%.
点评:此题是对化学方程式计算的考查,解题的关键是找到已知量,此题则是利用图象的分析求出生成的碳酸钙的质量,而后根据它的质量求出其它的需要的物质的质量解答即可.

练习册系列答案
 能力评价系列答案
能力评价系列答案
相关题目
 现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl).反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl).反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题: 现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl).反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl).反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题: 现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl).反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题:
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl).反应时CaCl2溶液与沉淀的质量关系如图所示.请解决以下问题: