题目内容
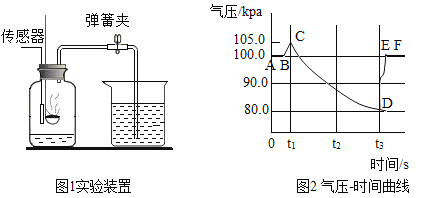
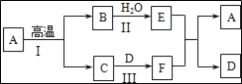
【题目】A~F是初中常见的化合物,有如下转化关系(部分生成物已省略)。其中A是大理石的主要成分,C可用于灭火,F俗名纯碱。
请回答下列问题:
①E的俗名为_____,写出物质E在农业上的一种用途_____,E与F反应的化学方程式为_____。
②反应I的化学方程式为_____,该反应是_____反应(填基本反应类型)。
③A、E均能与盐酸反应,反应的化学方程式分别为_____、_____。
【答案】熟石灰(消石灰) 改良酸性土壤(配置农药波尔多液) Ca(OH)2+Na2CO3═2NaOH+CaCO3↓ CaCO3 ![]() CaO+CO2↑ 分解 CaCO3+2HCl═CaCl2+H2O+CO2↑ Ca(OH)2+2HCl═CaCl2+2H2O
CaO+CO2↑ 分解 CaCO3+2HCl═CaCl2+H2O+CO2↑ Ca(OH)2+2HCl═CaCl2+2H2O
【解析】
①A~F是初中常见的化合物,A是大理石的主要成分,所以A是碳酸钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,C可用于灭火,所以C是二氧化碳,B是氧化钙,氧化钙和水反应生成氢氧化钙,所以E是氢氧化钙,F俗名纯碱,所以F是碳酸钠,D是氢氧化钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,经过验证,推导正确,所以E是氢氧化钙,俗称熟石灰,可以用来改良酸性土壤,E与F的反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为为:Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;
②反应I是碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3 ![]() CaO+CO2↑,该反应属于分解反应;
CaO+CO2↑,该反应属于分解反应;
③A、E均能与盐酸反应,反应的化学方程式分别为:CaCO3+2HCl═CaCl2+H2O+CO2↑,Ca(OH)2+2HCl═CaCl2+2H2O。
故答案为:①熟石灰(消石灰),改良酸性土壤(配置农药波尔多液),Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;
②CaCO3 ![]() CaO+CO2↑,分解;
CaO+CO2↑,分解;
③CaCO3+2HCl═CaCl2+H2O+CO2↑,Ca(OH)2+2HCl═CaCl2+2H2O。

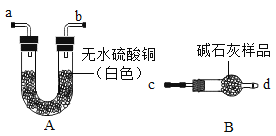
【题目】实验室常用的干燥剂有浓硫酸、碱石灰(CaO和NaOH的固体混合物)等,后者在潮湿的空气中易变质。某化学兴趣小组对实验室中一瓶久置的碱石灰展开探究。
[查阅资料]①碱石灰易吸收空气中的水蒸气和二氧化碳 ②氯化钙溶液呈中性,碳酸钠溶液呈碱性 ③碳酸钠和氢氧化钙溶于水温度变化不明显 ④Ca(OH)2分解温度为580℃,CaCO3分解温度为825℃,Na2CO3的分解温度为1744℃。
[提出问题]碱石灰是否变质?其成分可能有哪些?
[进行猜想]①若没有变质,碱石灰吸水性良好,成分只有CaO和NaOH;
②若变质,该碱石灰中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上。
[实验过程]
(1)验证碱石灰是否变质:图中的B为干燥装置,常用于固体干燥剂干燥气体。现用A、B装置检验碱石灰是否变质,取适量的无水硫酸铜和碱石灰样品分别装入A、B中,连接好A、B装置,从 ____(填“c”或“d”)端向B中缓缓通入水蒸气,观察A装置中的现象为____,证明碱石灰已变质。
(2)验证碱石灰是否完全变质:取适量碱石灰样品放入试管中,加入足量蒸馏水使其充分溶解,溶液变浑浊,用手触摸试管外壁,温度无明显变化,证明碱石灰已完全变质。则样品成分最多有___种可能性(填数字)。
(3)为进一步确定碱石灰样品的成分,该小组继续实验并记录如下:
实验编号 | 实验操作 | 实验目的、现象或数据 | 实验结论 |
实验一 | ①取适量样品于试管中,加入足量蒸馏水使其充分溶解; ②过滤,得到滤渣A和滤液B;③向滤液B中加入足量CaCl2溶液,静置; ④________。 | 操作③的主要目的是:___ 操作④的现象:____ | 样品中一定有Ca(OH)2 |
实验二 | ①取干燥样品50g,控制在600℃内,加热至质量不再发生变化,冷却后称量; ②将①中剩余固体控制在850℃内反复加热,冷却后称量。 | 操作①中称得固体质量为45.5g;操作②固体质量无变化。 | 样品中一定没有_____(填化学式) |
[探究结论] 通过整个探究活动分析得知碱石灰样品的成分是______(填化学式),其中盐的质量分数为_____。
[反思与评价] 通过探究活动,大家知道该碱石灰变质的化学反应过程,其中生成盐的化学方程式为______;明白了碱石灰要密封保存的原因。
【题目】合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等,化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。
称量10g粉末状黄铜样品放入烧杯中,量取45mL稀盐酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(ml) | 15 | 15 | 15 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)