题目内容
(2012?金坛市一模)Na2O2是一种淡黄色固体,能与H2O、CO2、HCl等物质反应.某兴趣小组结合化学课学习的内容,探究Na2O2能否和氢气反应.(已知无水CuSO4是白色粉末,遇水变成蓝色,碱石灰是氢氧化钠固体与生石灰的混合物)
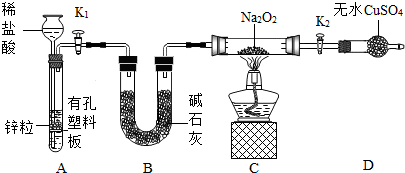
①按图组装仪器,(图中夹持仪器省略)
②检查气密性(气密性良好),装入药品Na2O2
③打开K1、K2,产生的氢气流经装有Na2O2 的硬质玻璃管,一段时间后没有任何现象;
④检验氢气的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色;
⑤反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1.
请回答下列问题:
(1)B装置的作用
A.吸收氢气中混有的氯化氢气体
B.吸收氢气携带的水蒸气
C.吸收装置A、B中空气中的二氧化碳
(2)步骤③目的是
(3)步骤⑤关闭K1后,将看到A装置中的现象
(4)通过现象可知Na2O2能和氢气反应.请推测它们反应的生成物
A.NaOH B.Na2CO3、H2O C.NaOH、H2O D.NaOH、O2.

①按图组装仪器,(图中夹持仪器省略)
②检查气密性(气密性良好),装入药品Na2O2
③打开K1、K2,产生的氢气流经装有Na2O2 的硬质玻璃管,一段时间后没有任何现象;
④检验氢气的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色;
⑤反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1.
请回答下列问题:
(1)B装置的作用
ABC
ABC
(填字母).A.吸收氢气中混有的氯化氢气体
B.吸收氢气携带的水蒸气
C.吸收装置A、B中空气中的二氧化碳
(2)步骤③目的是
排尽装置内的空气,防止Na2O2与空气中的物质反应
排尽装置内的空气,防止Na2O2与空气中的物质反应
.(3)步骤⑤关闭K1后,将看到A装置中的现象
液体被压入长颈漏斗中,固液分离,反应停止
液体被压入长颈漏斗中,固液分离,反应停止
.(4)通过现象可知Na2O2能和氢气反应.请推测它们反应的生成物
A
A
(填字母).A.NaOH B.Na2CO3、H2O C.NaOH、H2O D.NaOH、O2.
分析:(1)根据B装置中的碱石灰的性质分析;
(2)步骤③的目的是使氢气排尽装置内的空气,防止Na2O2与空气中的物质反应;
(3)根据试管内气体压强分析;
(4)根据信息:淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色,和质量守恒定律分析.
(2)步骤③的目的是使氢气排尽装置内的空气,防止Na2O2与空气中的物质反应;
(3)根据试管内气体压强分析;
(4)根据信息:淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色,和质量守恒定律分析.
解答:解:(1)碱石灰是氢氧化钠固体与生石灰的混合物,其中的氢氧化钠可以吸收氢气中混有的氯化氢气体,吸收装置A、B中空气中的二氧化碳;氧化钙可以吸收氢气携带的水蒸气.
故答案为:A B C.
(2)步骤③的目的是使氢气排尽装置内的空气,防止Na2O2与空气中的物质反应;
故答案为:排尽装置内的空气,防止Na2O2与空气中的物质反应.
(3)关闭K1后,试管内气压增大,将液体压回长颈漏斗,固液分离,反应停止.
故答案为:液体被压入长颈漏斗中,固液分离,反应停止.
(4)淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色,说明没有水生产,根据质量守恒可知生成物应该是NaOH.
故答案为:A.
故答案为:A B C.
(2)步骤③的目的是使氢气排尽装置内的空气,防止Na2O2与空气中的物质反应;
故答案为:排尽装置内的空气,防止Na2O2与空气中的物质反应.
(3)关闭K1后,试管内气压增大,将液体压回长颈漏斗,固液分离,反应停止.
故答案为:液体被压入长颈漏斗中,固液分离,反应停止.
(4)淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色,说明没有水生产,根据质量守恒可知生成物应该是NaOH.
故答案为:A.
点评:本题是一综合性较强的题目,要了解碱石灰的性质、实验装置的特点和性能、质量守恒的应用等,综合考查同学们对物质的性质和实验装置的应用能力.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目