题目内容
新型材料纳米级Fe粉具有广泛的用途,它比普通Fe粉更易与氧气反应,其制备工艺流程如下图所示: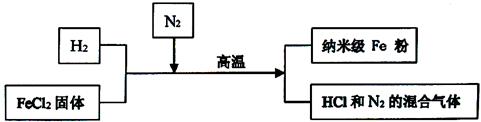
请回答下列问题:
(1)纳米级Fe粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为 。
(2)请补充完成上述制备工艺的化学方程式:H2 +FeCl2  Fe+ 。
Fe+ 。
(3)研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质。
①为除去样品中的杂质,在无氧环境下,先加 溶解,然后再 、洗涤、烘干.
②取样品20g,加入足量的盐酸,生成氢气0.7g。请计算该样品中单质Fe的质量分数。
(请写出计算过程)____ 。
(1)Fe3O4 (2) 2HCl (3)水 过滤 98%
解析试题分析:(1)根据铁在氧气中燃烧生成四氧化三铁,纳米级Fe粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为:Fe3O4 ;
(2)根据化学反应前后的原子的种类和个数不变得2HCl
(3)①纳米级铁不溶于水,而FeCl2溶于水,故先加水溶解,然后再过滤、洗涤、烘干.
②解设20g样品中铁的质量为xg
Fe + 2HCl=FeCl2 + H2↑
56 2
x 0.7g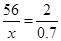
x=19.6g
样品中铁的质量分数=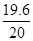 x 100% =98%
x 100% =98%
考点:质量守恒定律、利用化学方程式的计算。

在反应3X+4Y=2Z中,已知X的相对分子质量是32,Z的相对分子质量是102,则Y的相对分子质量为
| A.27 | B.70 | C.108 | D.1 72 |
工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响 (写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为 .
根据质量守恒定律,6g碳和32g氧气充分反应后,生成二氧化碳的质量为
| A.38g | B.22g | C.26g | D.14g |

