题目内容
【题目】室温下,将氢氧化钠溶液慢慢滴入装有稀盐酸的烧杯中,用温度计测量出烧杯中溶液的温度,溶液温度随加入氢氧化钠溶液的质量而变化的曲线如图:
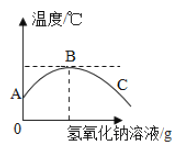
(1)由图可知,两溶液发生的反应是______(填“放热”或“吸热”)反应;
(2)从A到B过程中,烧杯中溶液的pH逐渐______;
(3)______点时恰好完全反应,C点的溶液中含有的溶质为______。
【答案】放热 增大 B 氯化钠和氢氧化钠
【解析】
(1)由溶液温度随加入氢氧化钠溶液的质量而变化的曲线图,随着反应的进行,溶液的温度逐渐升高,两溶液发生的反应是放热反应。
(2)从A到B过程中,氢氧化钠溶液与稀盐酸反应生成氯化钠和水,酸性逐渐变弱,烧杯中溶液的pH逐渐增大。
(3)中和反应属于放热反应,B点时放出的热量最高,恰好完全反应;C点是完全反应后继续滴加氢氧化钠溶液,C点的溶液中含有的溶质为氯化钠和氢氧化钠。

 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】某实验小组为了探究影响过氧化氢分解快慢的因素,进行了下列实验:
实验 序号 | 过氧化氢溶液浓度 | 过氧化氢溶液的体积/mL | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/mL | 收集氧气所需的时间/s |
1 | 5 | 1 | 20 | 0.1 | 4 | a |
2 | 15 | 1 | 20 | 0.1 | 4 | b |
3 | 30 | 5 | 35 | 0.1 | 4 | c |
4 | 30 | 5 | 55 | 0.1 | 4 | d |
(1)欲探究温度在实验中是否有影响,应该比较_____(填实验序号):从实验收集的是数据看,a>b,即实验②收集等量氧气所需时间比实验①少,由此可得出的结论是_____。
(2)请写出过氧化氢分解的化学方程式:_____。
(3)除测定收集相同体积的氧气所需的时间外,还可通过测定_____的方法比较过氧化氢分解的快慢。
(4)若其他条件相同,则催化剂的种类可能会影响到催化效果请设计实验方案进行验证:_____。
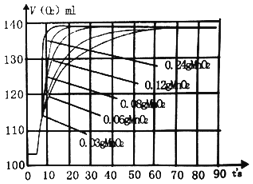
(5)该小组同学还使用了压强传感器测不同质量的二氧化锰对过氧化氢分解反应的影响,他在8mL 3%的过氧化氢溶液中分别加0.03g、0.06g、0.08g、0.12g、0.24g的二氧化锰,压强的变化曲线如图所示(说明,曲线的斜率表征催化剂反应的速率)。
请相据图示写出两条规律性的结论:
(1)_____,(2)_____。