题目内容
将锌粉和铜粉的混合物32.5g加入到93.7g稀硫酸中恰好完全反应,滤出不溶物,将其洗涤、干燥,在空气中充分灼烧后,所得固体质量也为32.5g.求:(1)原混合物中铜的质量分数.
(2)反应后溶液中溶质的质量分数(滤液损失不计).
【答案】分析:混合物中锌与稀硫酸反应,不溶物为铜,灼烧后所得固体为氧化铜,所以原混合物中Cu的质量分数等于氧化铜中铜元素的质量分数;混合物与稀硫酸反应后所得溶液为硫酸锌溶液,由硫酸锌的质量和所得溶液质量计算得出溶质质量分数..
解答:解:(1)根据题意,原混合物中Cu的质量分数等于氧化铜中铜元素的质量分数
Cu%= ×100%=
×100%= ×100%=80%;
×100%=80%;
或设原混合物中Cu的质量为x
2Cu+O2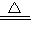 2CuO
2CuO
128 160
x 32.5g
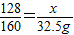
x=26g
Cu%= ×100%=80%
×100%=80%
(2)原混合物中锌的质量为:
32.5g×(1-80%)=6.5g或32.5g-26g=6.5g.
设生成硫酸锌的质量为y,生成氢气的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
6.5g y z
则 ,解得y=16.1g
,解得y=16.1g
 ,解得,z=0.2g
,解得,z=0.2g
反应后溶液中溶质的质量分数= ×100%=16.1%;
×100%=16.1%;
答:(1)原混合物中铜的质量分数是80%.
(2)反应后溶液中溶质的质量分数是16.1%(滤液损失不计).
点评:本题中的锌粉和铜粉中和稀硫酸反应的只能是锌粉,它说恰好完全反应,说明锌粉已经没有了,只剩下铜粉,即不溶物全是铜粉.
解答:解:(1)根据题意,原混合物中Cu的质量分数等于氧化铜中铜元素的质量分数
Cu%=
 ×100%=
×100%= ×100%=80%;
×100%=80%;或设原混合物中Cu的质量为x
2Cu+O2
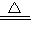 2CuO
2CuO128 160
x 32.5g
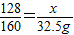
x=26g
Cu%=
 ×100%=80%
×100%=80%(2)原混合物中锌的质量为:
32.5g×(1-80%)=6.5g或32.5g-26g=6.5g.
设生成硫酸锌的质量为y,生成氢气的质量为z.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
6.5g y z
则
 ,解得y=16.1g
,解得y=16.1g  ,解得,z=0.2g
,解得,z=0.2g反应后溶液中溶质的质量分数=
 ×100%=16.1%;
×100%=16.1%;答:(1)原混合物中铜的质量分数是80%.
(2)反应后溶液中溶质的质量分数是16.1%(滤液损失不计).
点评:本题中的锌粉和铜粉中和稀硫酸反应的只能是锌粉,它说恰好完全反应,说明锌粉已经没有了,只剩下铜粉,即不溶物全是铜粉.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目