题目内容
13.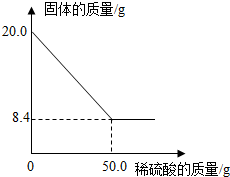 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示.请计算:
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应(菱铁矿中杂质不参加反应,且难溶于水),测得固体质量与所加稀硫酸的质量关系如图所示.请计算:(1)20.0g菱铁矿中FeCO3的质量为11.6g;
(2)恰好完全反应时,所得溶液的溶质质量分数(结果准确到0.1%)
分析 (1)根据剩余固体的质量即为杂质的质量,依据杂质的质量可以计算FeCO3的质量;
(2)根据生成物硫酸亚铁的质量和溶液质量计算溶质质量分数.
解答 解:(1)20.0g菱铁矿中FeCO3的质量为:20.0g-8.4g=11.6g;
(2)设生成FeSO4质量为x,CO2质量为y
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 142 44
11.6g x y
$\frac{116}{11.6g}=\frac{142}{x}=\frac{44}{y}$
x=14.2g
y=4.4g
所得溶液的质量为:11.6g+50g-4.4g=57.2g
所得溶液的溶质质量分数为:$\frac{14.2g}{57.2g}$×100%≈24.8%.
故答案为:(1)11.6g;
(2)所得溶液的溶质质量分数为24.8%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
1.某化合物是由氢、氧及另一种元素组成,下列对该化合物判断正确的是( )
| A. | 可能是氧化物 | B. | 可能是盐 | C. | 一定是碱 | D. | 不可能是酸 |
18.如图是某元素的原子结构示意图和该元素在元素周期表中的单元格,下列说法不正确的是( )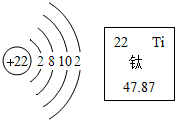

| A. | 该原子的最外层电子能量比最内层电子能量大 | |
| B. | 该原子在化学变化中容易失去电子 | |
| C. | 该元素属于金属元素 | |
| D. | 该原子的质量由其原子的质子和电子决定 |
3.下列每组食品中均富含蛋白质的是( )
| A. | 肥肉、花生 | B. | 鱼肉、鸡蛋 | C. | 香蕉、黄瓜 | D. | 馒头、大米饭 |
 水是宝贵的自然资源.
水是宝贵的自然资源.