摘要:C.该元素的符号是Si D.该元素的相对原子质量为28.09g
网址:http://m.1010jiajiao.com/timu_id_925252[举报]
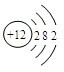 元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富.下面是元素周期表部分内容,请回答下列问题:
元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富.下面是元素周期表部分内容,请回答下列问题:| 1 H 氢 |
2 He 氦 | ||||||
| 3 Li 锂 |
4 Be 铍? |
5 B? 硼 |
6 C? 碳 |
7 N? 氮 |
8 O? 氧 |
9 F? 氟 |
10 Ne? 氖 |
| 11 Na ?钠? |
12 Mg ? |
13 A1 ?铝? |
14 Si ?硅 |
15 P ?磷 |
16 S ?硫 |
17 Cl? 氯 |
18 Ar? 氩 |
13
13
;(2)在元素周期表中,原子序数为12的元素是(填元素名称)
镁
镁
元素,属于(填“金属”或“非金属”)金属
金属
元素,其原子结构示意图为如图,在化学反应中该原子易失去
失去
(填“得到”或“失去”)2个
2个
电子,变成Mg2+
Mg2+
离子(写离子符号)(3)下列元素与原子序数为12的元素化学性质相似的是
A
A
(填序号).A.
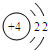 B.
B.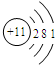 C.
C.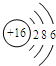 D.
D.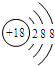
(4)通过分析,同一横行元素之间的排列有一定的规律,例如:
①从左到右,由金属元素逐渐向非金属元素过渡;
②
从左到右元素的原子序数依次增加
从左到右元素的原子序数依次增加
(任写一条).元素周期表是学习和研究化学的重要工具,请据表(元素周期表的部分内容)回答有关问题:
(1)请从表中查出关于硼元素的一条信息 .
(2)同一周期元素的原子,原子序数的变化规律是 .
(3)第3周期中属于金属元素的是 (填名称),这些金属元素的原子形成的阳离子其中之一是 (填序号).
(4)第11号元素与第16号元素组成的化合物是 (填符号),构成该物质的微粒是 (选填“分子”、“原子”或“离子”).
(5)在元素周期表中,同一族(纵行)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是 .(填标号)
a.C和Ne b.Be和Mg c.Al和Si d.F和Cl.
查看习题详情和答案>>
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | 3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(2)同一周期元素的原子,原子序数的变化规律是
(3)第3周期中属于金属元素的是
(4)第11号元素与第16号元素组成的化合物是
(5)在元素周期表中,同一族(纵行)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是
a.C和Ne b.Be和Mg c.Al和Si d.F和Cl.
元素周期表是学习和研究化学的重要工具.请根据下表(元素周期表的部分内容)回答有关问题:
(1)请从上表中查出关于硼元素的一条信息是 .
(2)表中不同种元素最本质的区别是 (填序号).
A.质子数不同 B.相对原子质量不同 C.电子数不同
(3)第12号元素与第17号元素组成化合物的化学式是 .
(4)上图的排列具有一定的规律,如同一周期中, .
(5)在第三周期中,具有相对稳定结构的原子是 (填符号或名称).
(6)下列各组元素具有相似化学性质的是 (填序号).
A.C和Ne B.Be和Mg C.Al和Si D.O和Cl
(7)某粒子的结构示意图为,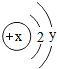 当x-y=5(y≠0)时,该粒子为 (填粒子符号).
当x-y=5(y≠0)时,该粒子为 (填粒子符号).
查看习题详情和答案>>
| 一 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | 3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 三 | 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(2)表中不同种元素最本质的区别是
A.质子数不同 B.相对原子质量不同 C.电子数不同
(3)第12号元素与第17号元素组成化合物的化学式是
(4)上图的排列具有一定的规律,如同一周期中,
(5)在第三周期中,具有相对稳定结构的原子是
(6)下列各组元素具有相似化学性质的是
A.C和Ne B.Be和Mg C.Al和Si D.O和Cl
(7)某粒子的结构示意图为,
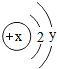 当x-y=5(y≠0)时,该粒子为
当x-y=5(y≠0)时,该粒子为元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| 族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:_______________ ____________。
(2)不同元素的本质区别是 ( )
A.质子数 B.电子数 C.中子数 D.相对原子质量
(3)如图是钠原子的结构示意图,判断该原子容易 (填“得到”或“失去”)电子,钠离子的符号为
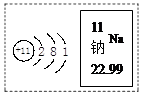
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
a.C和Ne b.Be和Mg c.Al和Si d.F和Cl
(5)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻, 其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水(H2O,用化学式表示该反应 。 查看习题详情和答案>>
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表部分内容),回答有关问题:
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)请从上表中查出关于硅元素的一条信息: 。
(2)第6号元素与地壳中含量最多的元素可组成一种物质是 (填名称)。这两种元素的原子还可以形成一种阴离子,该离子符号是 。
(3)第3周期里金属活动最强的金属元素与第17号元素组成的化合物的化学式是 。构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)查得资料:在元素周期表中,同一纵行(族)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是 (填标号)。.
a、Li和Na b、C和N c、B和Mg d、Ne和Ar
(5)第9号元素的气体单质(F2)常温下与水发生反应,生成氢氟酸(HF)和另一种无色气体单质,该反应的化学方程式为 。 查看习题详情和答案>>