摘要:CuCO3?Cu(OH)2 2CuO+CO2↑+H2O 反应 CuCO3+2HCl==CuCl2+CO2↑+H2O 仔细查阅上表资料.上述方案最可行的是 .
网址:http://m.1010jiajiao.com/timu_id_920547[举报]
自然界中,铜多存在于矿石中,如:
(1)辉铜矿中,铜的质量分数应
(2)铜在潮湿的空气中易生成铜绿[CuCO3?Cu(OH)2].为了除去铜器表面的铜绿,某同学提出以下三种方案:
Ⅰ.用水洗;Ⅱ.用稀盐酸洗;Ⅲ.加热.
已知:
仔细查阅上表资料,上述方案最可行的是
(3)根据化学方程式计算:加热2.22 g CuCO3?Cu(OH)2使之完全分解,计算剩余固体的质量.
查看习题详情和答案>>
| 矿石名称 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
<
<
80%(填“>”、“<”或“=”).(2)铜在潮湿的空气中易生成铜绿[CuCO3?Cu(OH)2].为了除去铜器表面的铜绿,某同学提出以下三种方案:
Ⅰ.用水洗;Ⅱ.用稀盐酸洗;Ⅲ.加热.
已知:
| 溶解性 (20℃) |
阴离子 阳离子 |
OH- | Cl- | CO | ||||
| Cu2+ | 不 | 溶 | 不 | |||||
| 有关反应 | CuCO3?Cu(OH)2
| |||||||
| CuCO3+2HCl=CuCl2+CO2↑+H2O | ||||||||
Ⅱ
Ⅱ
(填序号代码).(3)根据化学方程式计算:加热2.22 g CuCO3?Cu(OH)2使之完全分解,计算剩余固体的质量.
(2012?润州区二模)在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4?XH2O).
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水.对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解.
(2)CuSO4?XH2O可溶于水,在加热时会生成CuSO4和H2O.
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程: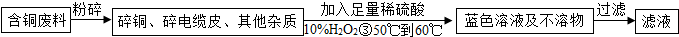
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是:
(2)从环保角度对两套方案的不同部分进行比较,你认为方案
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体.晶体采用酒精淋洗的优点是
II、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,
获得相关数据,并绘制成固体质量一温度的关系如图.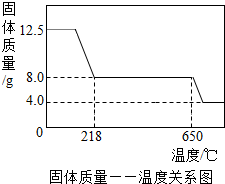
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
(3)根据图中数据,计算CuSO4?xH2O中x的值为
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式:
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
查看习题详情和答案>>
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水.对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解.
(2)CuSO4?XH2O可溶于水,在加热时会生成CuSO4和H2O.
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:

方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:
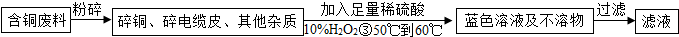
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是:
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
.(2)从环保角度对两套方案的不同部分进行比较,你认为方案
2
2
(填1或2)更合理.理由是:耗能少或无污染
耗能少或无污染
.(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为
防止H2O2受热分解
防止H2O2受热分解
.(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
将浓硫酸沿烧杯壁缓缓倒入水中
将浓硫酸沿烧杯壁缓缓倒入水中
并用玻璃棒不断搅拌
并用玻璃棒不断搅拌
.(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体.晶体采用酒精淋洗的优点是
减少硫酸铜晶体因溶于水而损失
减少硫酸铜晶体因溶于水而损失
.II、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,
获得相关数据,并绘制成固体质量一温度的关系如图.

(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为
白
白
色,最终变为黑色;(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
2CuSO4
2CuO+2SO2↑+O2↑;
| ||
2CuSO4
2CuO+2SO2↑+O2↑;
;
| ||
(3)根据图中数据,计算CuSO4?xH2O中x的值为
5
5
.(请写出计算过程)(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式:
Cu2O
Cu2O
.Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
+2
+2
.碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3?Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为CuSO4?3Cu(OH)2
CuSO4?3Cu(OH)2
,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是蛋白质
蛋白质
(填一种有机物名称).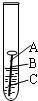 钢铁、铝合金、铜制品等是应用广泛的金属材料.据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
钢铁、铝合金、铜制品等是应用广泛的金属材料.据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:(1)如图,取一根约10cm的光亮铁钉放在自来水中,观察A、B、C三处的变化.
几天后,他们会发现
气中生锈实际是铁和
化学反应的过程.
(2)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈.他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿).他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应.
请写出铜在空气中生成铜绿的化学方程式
(3)【查阅资料】孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3?Cu(OH)2.
与孔雀石相似,还有许多矿物可用xCuCO3?yCu(OH)2(x、y都是正整数)表示,石青
就是其中的一种.
【实验探究】为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究.
| 实验步骤 | 实验现象 | 结论 | |
| 步骤1 | 取少量石青样品置于大试管中加入足量稀硫酸 | (1)产生大量气体 (2)溶液呈蓝色 |
(1)石青中含有 (2)石青中含有 |
| 步骤2 | 取少量石青样品置于大试管中加热 | (1)残留固体呈 (2)大试管内壁 |
石青加热易分解 |
①确定步骤1中产生气体成分的实验方法是
②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和
③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面
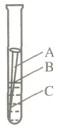 (2009?泰州)据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
(2009?泰州)据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:(1)如图,取一根约10cm的光亮铁钉放在自来水中,观察A、B、C三处的变化.几天后,他们会发现
B
B
处最先出现铁锈.(2)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈.他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿).他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应.请写出铜在空气中生成铜绿的化学方程式
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
.(3)[查阅资料]孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3?Cu(OH)2.与孔雀石相似,还有许多矿物可用xCuCO3?yCu(OH)2(x、y都是正整数)表示,石青就是其中的一种.
(4)[实验探究]为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究.

(5)[反思与拓展]
①确定步骤1中产生气体成分的实验方法是
将产生的气体通入足量的澄清石灰水中
将产生的气体通入足量的澄清石灰水中
.②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和
水或二氧化碳
水或二氧化碳
的质量,就可确定石青的化学式(即确定x、y的值).③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面
涂油、漆等
涂油、漆等
(任写一种方法). 钢铁、铝合金、铜制品等是应用广泛的金属材料.据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
钢铁、铝合金、铜制品等是应用广泛的金属材料.据估计,每年全世界被腐蚀损耗的钢铁材料,约占全年钢产量的十分之一.某校化学兴趣小组的同学探究金属腐蚀的原因,设计如下实验:
(1)如图,取一根约10cm的光亮铁钉放在自来水中,观察A、B、C三处的变化.
几天后,他们会发现________处最先出现铁锈,大家结合书本知识知道,铁在空
气中生锈实际是铁和________、________等物质相互作用发生一系列复杂的
化学反应的过程.
(2)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈.他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿).他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应.
请写出铜在空气中生成铜绿的化学方程式________.
(3)【查阅资料】孔雀石的主要成分是Cu2(OH)2CO3,也可以表示成CuCO3?Cu(OH)2.
与孔雀石相似,还有许多矿物可用xCuCO3?yCu(OH)2(x、y都是正整数)表示,石青
就是其中的一种.
【实验探究】为了验证石青的组成成分,他们设计了如下实验,请你共同参与探究.
| 实验步骤 | 实验现象 | 结论 | |
| 步骤1 | 取少量石青样品置于大试管中加入足量稀硫酸 | (1)产生大量气体 (2)溶液呈蓝色 | (1)石青中含有 ________离子 (2)石青中含有 ________离子 |
| 步骤2 | 取少量石青样品置于大试管中加热 | (1)残留固体呈 ________色 (2)大试管内壁 ________ | 石青加热易分解 |
①确定步骤1中产生气体成分的实验方法是________.
②根据以上探究,只要测定出参加反应的石青的质量、生成的氧化铜的质量和________的质量,就可确定石青的化学式(即确定x、y的值).
③防止金属锈蚀的方法很多,如制成不锈钢、在金属表面________(任写一种方法) 查看习题详情和答案>>