网址:http://m.1010jiajiao.com/timu_id_913348[举报]
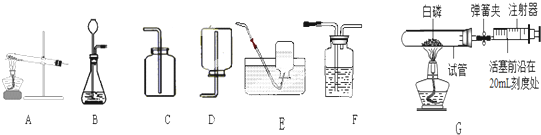
(1)实验室用装置B制取氧气时,收集装置可选用
(2)注射器可用于检查装置B的气密性,步骤如下:
①向锥形瓶中加入少量水至
②将注射器连接到装置B的导管口处.
③缓慢拉动注射器的活塞,观察到
(3)图G实验中(铁架台略去)操作步骤如下:
①点燃酒精灯.
②读取活塞数据.
③撤去酒精灯,待试管冷却后松开弹簧夹.
④将少量红磷平装入试管中,将活塞置于20mL刻度处,并按图G中所示连接方式固定好,再将弹簧夹紧橡皮管.
⑤检查装置气密性.
你认为正确实验操作顺序是
(4)图G实验中(选用容积为40mL的试管作反应容器),活塞将从20mL刻度处慢慢前移到约为
(5)实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解.CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用.小红同学作了以下分析和设计.
①小红同学认为最不可能的是H2O,她的理由是
②要说明另外的两种粒子是否起到催化作用,小红同学设计了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是 |
| ②另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴 |
溶液中有大量气泡放出 |
根据下列装置图,回答有关问题:
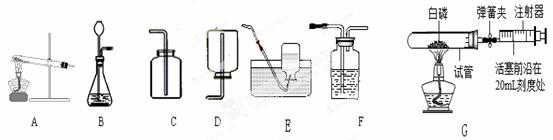
(1)实验室用装置B制取氧气时,收集装置可选用 ▲ ,写出反应的化学方程式 ▲ ;如用注射器替换长颈漏斗,优点是 ▲ ; 要得到一瓶干燥的氧气,所选装置连接顺序是 ▲ (填装置大写字母),可选用 ▲ 作干燥剂 。
。
(2)注射器可用于检查装置B的气密性,步骤如下:
①向锥形瓶中加入少量水至 ▲ 处.
②将注射器连接到装置B的导管口处.
③缓慢拉动注射器的活塞,观察到 ▲ ,表示装置B气密性良好.
(3)图G实验中(铁架台略去)操作步骤如下:
①点燃酒精灯.
②读取活塞数据.
③撤去酒精灯,待试管冷却后松开弹簧夹.
④将少量红磷平装入试管中,将活塞置于20mL刻度处,并按图G中所示连接方式固定好,再将弹簧夹紧橡皮管.
⑤检查装置气密 性.
性.
你认为正确实验操作顺序是 ▲ (填序号).
(4)图G实验中(选用容积为40mL的试管作反应容器),活塞将从20mL刻度处慢慢前移到约为 ▲ mL刻度处才停止.
(5 )实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解。CuSO4
)实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解。CuSO4 溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小红同学作了以下分析和设计。
溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用。小红同学作了以下分析和设计。
①小红同学认为最不可能的是H2O,她的理由是 ▲ 。
②要说明另外的两种粒子是否起到催化作用,小红同学设计了如下实验。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放 | 实验证明,起催化作用的是 ▲ 。 |
| ②另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴 ▲ | 溶液中有大量气泡放出 |
③如果确定CuSO4是催化剂,还必须通过实验确定它在化学反应前后
▲ 。
现有下列装置,回答问题:
 |
(1)写出有标号仪器的名称:① ▲ ;② ▲ ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ▲ ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 ▲ 发生装置为 ▲ ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ▲ ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验。
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b |
【实验内容】:
【实验分析】:
①完善上表中的填空内容:a ▲ 、b ▲ ;
②实验2的目的是 ▲ ;
③经讨论,实验1的结论不正确,理由是 ▲ ;
 【资料】:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
【资料】:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 2K2MnO4 + K2Mn4O8 + 4O2↑ b、KMnO4 KMnO2 + O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为 ▲ (2分)
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0% 。结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 ▲ (填“a”或“b”)为主。
查看习题详情和答案>>现有下列装置,回答问题:
 |
(1)写出有标号仪器的名称:① ▲ ;② ▲ ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ▲ ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 ▲ 发生装置为 ▲ ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ▲ ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验。
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b |
【实验内容】:
【实验分析】:
①完善上表中的填空内容:a ▲ 、b ▲ ;
②实验2的目的是 ▲ ;
③经讨论,实验1的结论不正确,理由是 ▲ ;
 【资料】:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
【资料】:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 2K2MnO4 + K2Mn4O8 + 4O2↑ b、KMnO4 KMnO2 + O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为 ▲ (2分)
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0% 。结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 ▲ (填“a”或“b”)为主。
查看习题详情和答案>>现有下列装置,回答问题:
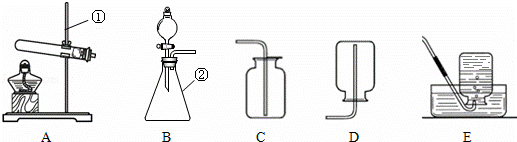
(1)写出有标号仪器的名称:① ;② ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 发生装置为 ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b |
[实验内容]:
[实验分析]:
①完善上表中的填空内容:a 、b ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4 KMnO2+O2↑
KMnO2+O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 (填“a”或“b”)为主.
查看习题详情和答案>> 出
出