摘要:8.n个CO2分子和n个SO2分子中 A.都含有氧分子 B.都含有一样多的氧原子C.都含有氧气 D.氧元素的质量分数相同
网址:http://m.1010jiajiao.com/timu_id_906905[举报]
已知:①反应2FeCl3+SO2+2H2O=FeCl2+FeSO4+4HCl 和反应P4+5O2=2P2O5 一样,都属于氧化还原反应;②离子方程式H++OH-=H2O 一般可用来表示强酸和强碱发生中和反应的实质(生成的盐为能溶于水的强电解质).请在由H、C、N、O、Na、Cl和Cu七种元素中任意组成的物质中选择适当的物质,回答以下问题:
(1)写出一个有三种或三种以上物质发生的化合反应的方程式:
(2)写出一个符合H++OH-=H2O的化学方程式:
(3)写出相对分子质量相等的分子式:
(4)等纯度的多种氮肥中A的肥效最高.则90%的A中氮元素的质量分数为
(5)H2O2不仅可以分解,它还有许多其它化学性质.在以下反应中,能够说明H2O2是一种二元弱酸的是
A.Na2O2+2HCl=2NaCl+H2O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.PbS+4H2O2=PbSO4+4H2O
D.2KMnO4+3H2SO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H′O.
查看习题详情和答案>>
(1)写出一个有三种或三种以上物质发生的化合反应的方程式:
2CuO+H2O+CO2═Cu2(OH)2CO3
2CuO+H2O+CO2═Cu2(OH)2CO3
.(2)写出一个符合H++OH-=H2O的化学方程式:
HCl+NaOH=NaCl+H2O
HCl+NaOH=NaCl+H2O
.(3)写出相对分子质量相等的分子式:
N2
N2
和CO
CO
.(4)等纯度的多种氮肥中A的肥效最高.则90%的A中氮元素的质量分数为
42%
42%
.(5)H2O2不仅可以分解,它还有许多其它化学性质.在以下反应中,能够说明H2O2是一种二元弱酸的是
A
A
,H2O2中氧元素化合价仅升高的反应是D
D
.A.Na2O2+2HCl=2NaCl+H2O2
B.2Na2O2+2H2O=4NaOH+O2↑
C.PbS+4H2O2=PbSO4+4H2O
D.2KMnO4+3H2SO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H′O.
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.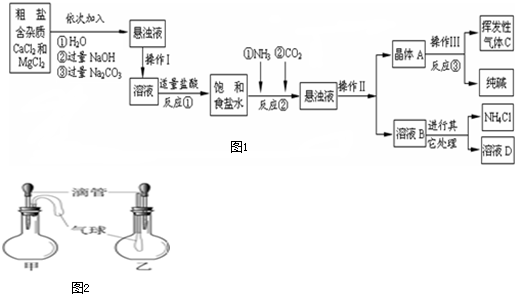
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为: (1分);分离出NaHCO3,加热制得纯碱.
【生产流程】如图1
【相关资料】
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如表(气体指1体积水中能溶解的气体体积)
【问题讨论】(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出这两个化学方程式:① ;② .
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法 .
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀. 由上述实验可确定纯碱样品含有杂质 (写化学式).
【综合确定】
(1)如图2所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:
A.甲:稀硫酸和铜片;乙:水和CO2 B.甲:水和NH4NO3;乙:双氧水和MnO2
C.甲:水和NH3;乙:硝酸银溶液和HCl D.甲:CaCO3固体和稀盐酸;乙:NaOH溶液和SO2
(2)小明同学把12gNaOH固体等分成A、B、C三份并采用不同方法保存.几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入10%的稀硫酸直到正好反应.下列说法正确的是
A.几天后,三份固体的质量由小到大的顺序为:A<B<C
B.为控制正好反应,A可用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C
D.正好反应时,生成硫酸钠的质量都相等,均为7.1g
(3)工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:①4NH3+5O2=4NO+6H2O ②2NO+O2=2NO2 ③3NO2+H2O=2HNO3+NO,下列判断不正确的是
A.①反应中使用的催化剂需要经常更换 B.在每一步反应中N元素的化合价都发生了改变
C.制取硝酸过程中产生的NO可循环使用
D.为实现原子利用率为100%,可在②③中控制NO、O2和H2O分子个数比为4:3:2
(4)某学生为了验证铁、锌、铜三种金属的活动性顺序.设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中 ②将Fe、Cu分别加入到ZnSO4溶液中 ③将Zn分别加入到FeSO4、CuSO4溶液中 ④将Fe分别加入到ZnSO4、CuSO4溶液中.其中可行的是
A.①④B.①②C.②③D.③④
查看习题详情和答案>>

【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为:
【生产流程】如图1
【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如表(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(2)反应①中发生了两个反应,写出这两个化学方程式:①
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀. 由上述实验可确定纯碱样品含有杂质
【综合确定】
(1)如图2所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:
A.甲:稀硫酸和铜片;乙:水和CO2 B.甲:水和NH4NO3;乙:双氧水和MnO2
C.甲:水和NH3;乙:硝酸银溶液和HCl D.甲:CaCO3固体和稀盐酸;乙:NaOH溶液和SO2
(2)小明同学把12gNaOH固体等分成A、B、C三份并采用不同方法保存.几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入10%的稀硫酸直到正好反应.下列说法正确的是
A.几天后,三份固体的质量由小到大的顺序为:A<B<C
B.为控制正好反应,A可用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C
D.正好反应时,生成硫酸钠的质量都相等,均为7.1g
(3)工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:①4NH3+5O2=4NO+6H2O ②2NO+O2=2NO2 ③3NO2+H2O=2HNO3+NO,下列判断不正确的是
A.①反应中使用的催化剂需要经常更换 B.在每一步反应中N元素的化合价都发生了改变
C.制取硝酸过程中产生的NO可循环使用
D.为实现原子利用率为100%,可在②③中控制NO、O2和H2O分子个数比为4:3:2
(4)某学生为了验证铁、锌、铜三种金属的活动性顺序.设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中 ②将Fe、Cu分别加入到ZnSO4溶液中 ③将Zn分别加入到FeSO4、CuSO4溶液中 ④将Fe分别加入到ZnSO4、CuSO4溶液中.其中可行的是
A.①④B.①②C.②③D.③④