摘要:①a点所表示的氯化钠溶液是 溶液. ②若要从饱和的氧化钠溶液中得到大量的氯化钠晶体.应采用的方法是 (填“蒸发溶剂"或“冷却热饱和溶液 ).
网址:http://m.1010jiajiao.com/timu_id_900876[举报]
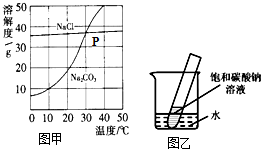 图甲为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.请回答下列问题:
图甲为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.请回答下列问题:(1)10℃时,碳酸钠的溶解度为
(2)P点表示
(3)当温度
(4)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”.请你解释原因:“冬天捞碱”
(5)如图乙所示,20℃时,将盛有饱和碳酸钠溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是
A.氢氧化钠 B.生石灰 C.硝酸铵 D.浓硫酸.
(2010?河东区一模)下图是常见固体物质的溶解度曲线,根据图示回答:

(1)图1中曲线上点M表示
(2)有A、B、C三只试管放在盛有冷水的烧杯中(如图3所示),向烧杯中加入适量浓硫酸,观察到
(3)t℃时,将40g食盐放入100g水中充分溶解,所得溶液中溶质的质量分数约为
查看习题详情和答案>>

(1)图1中曲线上点M表示
t°C时,硝酸钾和氯化钠的溶解度相同
t°C时,硝酸钾和氯化钠的溶解度相同
.(2)有A、B、C三只试管放在盛有冷水的烧杯中(如图3所示),向烧杯中加入适量浓硫酸,观察到
A中固体减少,C中出现浑浊
A中固体减少,C中出现浑浊
,此时B试管中溶液的状态不饱和
不饱和
(填“饱和”或“不饱和”)(3)t℃时,将40g食盐放入100g水中充分溶解,所得溶液中溶质的质量分数约为
27%
27%
.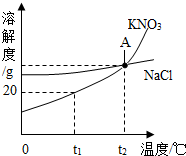 如图所示KNO3和NaCl的溶解度曲线,请回答下列问题.
如图所示KNO3和NaCl的溶解度曲线,请回答下列问题.(1)t1℃时KNO3的溶解度是
20g
20g
.(2)图中A点表示的意义是
t2℃时硝酸钾与氯化钠的溶解度相等
t2℃时硝酸钾与氯化钠的溶解度相等
.(3)欲从KNO3溶液中得到KNO3晶体,可采用的方法是
降温结晶或蒸发结晶
降温结晶或蒸发结晶
.(4)将t1℃时饱和溶液升温至t2℃,下列各项保持不变的是
ABCD
ABCD
(填序号).A.溶质质量 B.溶剂质量 C.溶液质量 D.溶质质量分数 E.溶解度.
(7分)中和反应是中学化学中重要的学习内容,其在日常生活和工农业生产中有广泛的应用。
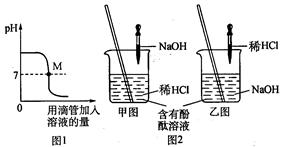
(1)上图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。
请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶
液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的_______(填甲或乙)图所示进行的。
②曲线上M点表示盐酸和氢氧化钠溶液反应的情况是_______。
③向烧杯中倾倒20 g(滴有2滴酚酞试液)质量分数为4.0%的氢氧化钠溶液,振荡,再逐滴滴入质量分数为7.3%的稀盐酸,边滴边振荡,直至溶液刚好变为_______色为止,共用去稀盐酸10 g,则反应后溶液中溶质质量分数为_______。要使反应后的溶液变成20℃时的饱和溶液,需要加入氯化钠固体的质量是_______g(结果精确到0.1 g)。已知:20℃时氯化钠的溶解度为36.0 g。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:
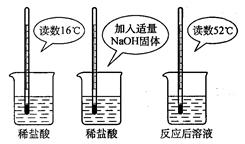
根据图示实验,甲同学认为:NaOH与稀盐 酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是__________。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5 g溶质质量分数分别为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40 g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:
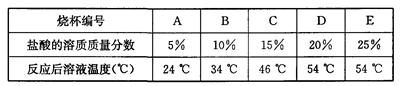
实验结论:影响该中和反应放出热量多少的因素是_______。

(1)上图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。
请从曲线图中获取信息,回答下列问题:
①图1图象表示盐酸和氢氧化钠溶
液发生反应过程中溶液的pH变化。进行该反应的实验操作是按照图2中的_______(填甲或乙)图所示进行的。
②曲线上M点表示盐酸和氢氧化钠溶液反应的情况是_______。
③向烧杯中倾倒20 g(滴有2滴酚酞试液)质量分数为4.0%的氢氧化钠溶液,振荡,再逐滴滴入质量分数为7.3%的稀盐酸,边滴边振荡,直至溶液刚好变为_______色为止,共用去稀盐酸10 g,则反应后溶液中溶质质量分数为_______。要使反应后的溶液变成20℃时的饱和溶液,需要加入氯化钠固体的质量是_______g(结果精确到0.1 g)。已知:20℃时氯化钠的溶解度为36.0 g。
(2)为证明中和反应是放热反应,某小组进行了如图所示的实验操作:

根据图示实验,甲同学认为:NaOH与稀盐 酸发生的中和反应是放热反应。乙同学认为:甲同学得出这个结论的依据不科学,理由是__________。
(3)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5 g溶质质量分数分别为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40 g 20%的氢氧化钠溶液,最后测量其温度,数据记录如下:

实验结论:影响该中和反应放出热量多少的因素是_______。
(1)碘酒溶液中溶质是______,溶剂是______;
(2)下列溶液中一定是饱和溶液的是______(填序号);
A.无色透明溶液 B.含有未溶氯化钠固体的氯化钠溶液
C.紫红色透明溶液 D.将硝酸钾溶液降温析晶后所得溶液
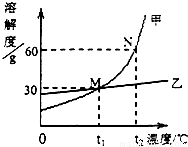
(3)将甲、乙两固体溶解于水中,其溶解度曲线如图所示,
①N点所表示的含义是______;
②t2℃时,甲物质的饱和溶液的质量分数为______;
③t1℃时,甲物质饱和溶液的质量分数______(填“>”、“<”或“=”)乙物质饱和溶液的质量分数;
④若甲和乙的混合溶液中含有少量乙物质,则提取甲物质的方法是______;
(4)用10g 98%的硫酸溶液(体积约为5mL)加入到90g水(体积为90mL)中,则所得硫酸溶液的质量分数为______;按上述要求配制好溶液后,实际测得溶液的体积小于95mL,配制前后溶液体积并不守恒,其原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
(2)下列溶液中一定是饱和溶液的是______(填序号);
A.无色透明溶液 B.含有未溶氯化钠固体的氯化钠溶液
C.紫红色透明溶液 D.将硝酸钾溶液降温析晶后所得溶液
(3)将甲、乙两固体溶解于水中,其溶解度曲线如图所示,
①N点所表示的含义是______;
②t2℃时,甲物质的饱和溶液的质量分数为______;
③t1℃时,甲物质饱和溶液的质量分数______(填“>”、“<”或“=”)乙物质饱和溶液的质量分数;
④若甲和乙的混合溶液中含有少量乙物质,则提取甲物质的方法是______;
(4)用10g 98%的硫酸溶液(体积约为5mL)加入到90g水(体积为90mL)中,则所得硫酸溶液的质量分数为______;按上述要求配制好溶液后,实际测得溶液的体积小于95mL,配制前后溶液体积并不守恒,其原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>