网址:http://m.1010jiajiao.com/timu_id_900706[举报]
小红同学向一定量的纯碱溶液中投入一定量的生石灰,充分反应冷却到常温后,观察到白色不溶物,过滤,得滤液A和白色固体B,上述过程中发生的化合反应方程式为:
【问题】:滤液成分是什么?白色固体的成分是什么?
【猜想】:
| 猜想 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 滤液A中的溶质 | NaOH | Na2CO3 NaOH | Ca(OH)2 NaOH | Ca(OH)2 NaOH |
| 白色固体B的成分 | CaCO3 | CaCO3 | CaCO3 | CaCO3、Ca(OH)2 |
【讨论】:猜想Ⅳ成立的理由:②
-------------------------------------
【实验】:小飞针对猜想Ⅱ中的滤液,开展如下验证实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液A于试管中,滴入几滴稀HCl | 无气泡产生 | 猜想不成立 |
【反思】:请你判断小飞的实验结论是否正确并解释原因③-------------------.
若要证明猜想Ⅱ中的滤液成分正确,你的操作为:-------------------.
猜想Ⅳ成立时:判断滤液A中含可用的一种物理方法是:---------------.
上述实验后的废液应怎样处理后才能倒入下水道?-------------.
查看习题详情和答案>>①
【问题】:滤液成分是什么?白色固体的成分是什么?
【猜想】:
| 猜想 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 滤液A中的溶质 | NaOH | NaOH、Na2CO3 | NaOH、Ca(OH)2 | NaOH、Ca(OH)2 |
| 白色固体B的成分 | CaCO3 | CaCO3 | CaCO3 | CaCO3、Ca(OH)2 |
【实验】:小飞针对猜想Ⅱ中的滤液,开展如下验证实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液A于试管中,滴入几滴稀HCl | 无气泡产生 | 猜想不成立 |
若要证明猜想Ⅱ中的滤液成分正确,你的操作为:④
猜想Ⅳ成立时:判断滤液A中含可用的一种物理方法是:⑤
上述实验后的废液应怎样处理后才能倒入下水道?⑥
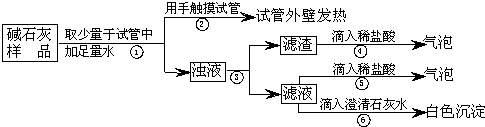
实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸气和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
(2)【实验】如下图所示:
 |
(3)【判断】
A.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,
则由操作②现象判断:猜想Ⅱ____ ___(填成立、不成立)
B.操作⑥发生化学反应的方程式为_____________ _________;
由操作⑤、⑥的现象判断:滤液中含有_________ __(写化学式);
由此判断猜想Ⅰ____ ___(填:成立、不成立)。
C.综合A和B的结论 ,判断该样品为 变质,(填部分或全部)
,判断该样品为 变质,(填部分或全部)
任写一个变质的化学方程式________________________________。
【拓展】由上述实验说明:实验室中“碱石灰”应_____保存;
操作③中玻璃棒的作用是 。
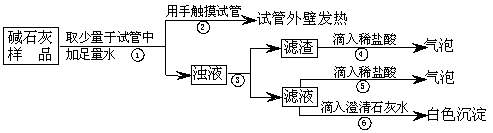
查看习题详情和答案>>(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.
(2)【实验】如图所示:

(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
b.操作④发生化学反应的方程式为
c.综合a和b的结论,判断该样品变质情况为
(4)【拓展】由上述实验说明,实验室中“碱石灰”应