网址:http://m.1010jiajiao.com/timu_id_891875[举报]
根据下列装置图回答问题。

Ⅰ.写出仪器①的名称是 ⑻ ,仪器②的名称 ⑼ 。
Ⅱ.实验室用一定质量的氯 酸钾制取氧气,通过排水量测定所收集到的氧气体积。
酸钾制取氧气,通过排水量测定所收集到的氧气体积。
①写出该反应的化学方程式 ⑽ 。
②若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请画出⑾ 。
③根据氯酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是 ⑿ 。
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究。
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关。
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克HCl的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
根据以上信息回答下列问题:
写出上述实验中反应的化学方程式 ⒀ 。
实验①与②的目的是为了探究 ⒁ 。
实验 ⒂ (填实验编号)的目的是为了探究大理石颗粒粗、细对反应快慢的影响。
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快。
拓展与反思:还有哪些因素可能影响该反应的速率快慢呢?请写出你的一个猜想: ⒃ 。
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有启普发生器原理 的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体, 该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
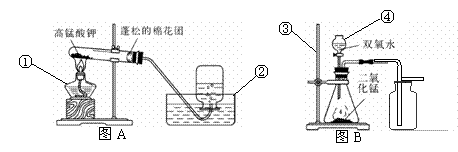 按下图所示装置回答下列问题。
按下图所示装置回答下列问题。
| |
(1)指出编号仪器的名称
①________; ②________; ③________; ④ ________
________
(2)实验室用图A装置制取氧气:
①图A中试管口要塞一团棉花,这样操作的目的是__________________________________。
②写出加热高锰酸钾制氧气的文字表达式___________________________________________。
③写出图A装置气密性的检验方法:__________________________________________________
_____________________________________________________________________________________。
④用排水法集气,开始收集氧气的适宜时刻是 ,说明氧气已收集满的现象是____________________________________________________________________。
⑤某同学在完成了加热高锰酸钾制取氧气的实验后,进行了仪器的整理,他发现自己所用的试管破裂了,造成破裂的原因可能是
A.没有给试管均匀预热 B.加热时试管口没有略向下倾
C.加热时试管与灯芯接触 D.排水法收集氧气后,先停止加热,再将导管从水中取出
(3)实验室用图B装置制取氧气:
①图B装置中,仪器④的主要作用是_____________________________________________________。
②检验图B集气瓶中氧气是否收集满的方法是____________________ ________________________。
________________________。
③某同学观察到图B装置中锥形瓶内有大量气泡产生,过一段时间后用带火星的木条伸入集气瓶的瓶口、瓶中、瓶底,都未见木条复燃。其可能原因是 。
查看习题详情和答案>>
Ⅰ.写出仪器①的名称是
Ⅱ.实验室用一定质量的氯酸钾制取氧气,通过排水量测定所收集到的氧气体积.
①写出该反应的化学方程式
| ||
| △ |
| ||
| △ |
②若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请画出


③根据氯酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究.
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关.
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克HCl的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
写出上述实验中反应的化学方程式
实验①与②的目的是为了探究
实验
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快.
拓展与反思:还有哪些因素可能影响该反应的速率快慢呢?请写出你的一个猜想:
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有启普发生器原理的
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体.上图中制取较纯乙炔的最适宜发生和收集装置是
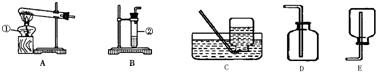
(1)写出有编号仪器的名称:①
(2)小明用氯酸钾和二氧化锰混合加热制取氧气的发生装置可选用(填代号,下同)
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
(3)小华用B装置制取氧气,她需要的药品
| 二氧化锰 |
| 二氧化锰 |
(4)如果用高锰酸钾制取氧气用排水法收集,应对图中装置作稍微的改动是
开始收集氧气的最适宜时刻是
实验结束后应进行的操作是:先
若不这样操作的后果是
有同学想验证一下排空气法氧气是否已经集满集气瓶,具体的操作是
(5)能用C装置收集的气体,必须具备的性质是
(6)如果用高锰酸钾制取氧气时试管口要略向下倾斜的原因是
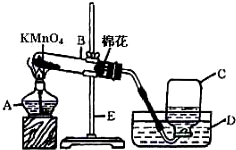
(1)指出编号仪器名称:
A
写出该反应的文字表达式:
| 加热 |
| 加热 |
(2)在试管口处放一小团棉花其作用是
等集气瓶内的水完全排出后,用玻璃片盖住瓶口,把集气瓶小心移出水槽后,集气瓶应