网址:http://m.1010jiajiao.com/timu_id_555354[举报]
(每题2分)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
C
A
A
B
B
B
B
A
题号
11
12
13
14
15
16
17
18
19
20
答案
B
C
A
D
B
D
C
B
C
C
21.(每空1分,共3分)ClO- 和 Cl-; 1
22.(6分,每空2分)(1)Na2SiO3+ CO2+ H2O= H2SiO3↓+ Na2CO3
(2)Na2SiO3+2HCl= H2SiO3↓+ 2NaCl
(3)Na2CO3+2HCl= 2NaCl+ CO2↑+ H2O
23.(4分,每空1分)A:CaBr2;B:AgNO3;C:CuSO4;D:K2CO3。
24.(7分,其中⑴2分,其余每空1分)⑴ ;
沸腾炉
;
沸腾炉
(2)SO3、SO2、O2;C、B、A (3)98%浓硫酸,接触室
25.(8分,每空2分) (1)CO2
(2)Al3++4OH- = AlO2-+ 2H2O
(3)2Al+3CuO 3Cu+Al2O3
3Cu+Al2O3
(4)0.75
26.(每空1分,共7分)
(1)甲 丙 戊
(2)乙 有较多气泡放出的为稀硫酸
(3)丁 浓硫酸不具有挥发性
27.(10分,其中(3)4分,(4)2分,其余每空1分)
(1)乙 亚铁盐在空气中易被氧气氧化 (2) 还原
(3) 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-=Fe(SCN)3 。
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理 (5) 未能测其成分。
28.(7分,其中(1)3分,(2)4分) (1)3分 (2)55.79%
29.(8分)
(2分)(1)Al3+ + 3OH―= Al (OH)3↓;Al (OH)3 + OH―= AlO2―+ 2H2O
(6分)(2)1.5 mol?L―1或3.5 mol?L―1
已知:n (AlCl3)
=  = 0.1mol (1分)
= 0.1mol (1分)
n (Al (OH)3) =  = 0.05mol (1分)
= 0.05mol (1分)
①NaOH溶液不足 Al3+ + 3OH―= Al (OH)3↓
0.15mol 0.05mol
c (NaOH) =  = 1.5 mol?L―1 (2分)
= 1.5 mol?L―1 (2分)
②NaOH溶液过量Al3+ + 3OH―= Al (OH)3↓ Al (OH)3 + OH―= AlO2―+ 2H2O
0.1mol 0.3mol 0.1mol 0.05mol 0.05mol
c (NaOH) =  = 3.5 mol?L―1(2分)
= 3.5 mol?L―1(2分)
(共15分)I(8分) (1)(4分)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察 ,定性比较得出结
论。观察两同学的方案,你认为 (填“甲”或“乙”)更合理。 理由
是 。
 |
(2) (4分)丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。
II(7分)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。
查看习题详情和答案>>已知下列数据:
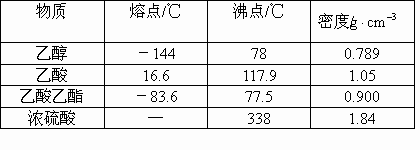
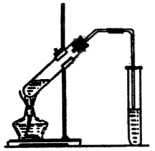
实验室制乙酸乙酯的主要步骤:
在30mL的大试管中按1:4:4的比例配制浓![]() 、乙醇和乙酸的混合液.
、乙醇和乙酸的混合液.
②如图5-22连接装置,使产生的蒸气经导管通到盛有4mL饱和![]() 溶液(加入滴酚酞试液的15mL试管中.)
溶液(加入滴酚酞试液的15mL试管中.)
③小火加热大试管中的混合物
④待小试管收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层.
⑤分离纯净的乙酸乙酯
请回答下列问题:
(1)如何配制这一定比例的混合液________.
(2)写出该反应的化学方程式________反应中浓![]() 的作用是________.
的作用是________.
(3)在反应装置中,导气管出口的位置在![]() 液面上方2-3mm处,其理由是________;步骤③中为什么要小火加热________.
液面上方2-3mm处,其理由是________;步骤③中为什么要小火加热________.
(4)指出步骤④所观察到的现象是________.
原因与结论是________.
(5)为了提高乙酸乙酯的产率,甲、乙两同学分别设计了如图5-23、图5-24装置,乙同学待反应完毕后,放冷烧瓶中的液体,再用饱和![]() 溶液提取产物,你认为哪种装置合理?为什么?
溶液提取产物,你认为哪种装置合理?为什么?
(1)元素D在周期表中的位置


(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种粒子,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量.试写出该反应的热化学方程式:
②B2A4是一种可燃性液体,B2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,该电池放电时的负极反应式为:



①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按照图I连接装置,使产生的蒸气经导管通到15mL试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处,
③小火加热试管中的混合液;
④待小试管中收集约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯。
请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_________。
(2)写出该反应的化学方程式_______________,浓H2SO4的作用是______________。
(3)步骤③中,用小火加热试管中的混合液,其原因与结论_________________。
(4)步骤④所观察到的现象是______________,原因是____________________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出,因为__________________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答:___________________________。



请同学们回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是_________________________________。
(2)写出该反应的化学方程式_____________________________,浓H2SO4的作用是___________________________。
(3)步骤③中,用小火加热试管中的混合液,其原因与结论__________________________。
(4)步骤④所观察到的现象是_________,原因是________________________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是_________,产物应从_________口倒出,因为__________________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答:_____________________________。