网址:http://m.1010jiajiao.com/timu_id_523543[举报]
物理部分参考答案
14.B 15. D
22.(I)(1)A (2) ;
; B
B
II(1)

(2)A1 ; R1
23.(14分)解:(1)陈若琳跃起后可看作竖直向上的匀减速运动,重心上升的高度
设起跳速度为 ,则
,则 ,上升过程的时间
,上升过程的时间
解得 (2分)
(2分)
陈若琳从最高处自由下落到手触及水面的过程中重心下落的高度
 (2分)
(2分)
设下落过程的时间为 ,则
,则
解得 (2分)
(2分)
陈若琳要完成一系列动作可利用的时间
 (2分)
(2分)
(2)设从最高点到水面下最低点的过程中,重力做的功为 ,克服水的作用力的功为
,克服水的作用力的功为
由动能定理可得 (2分)
(2分)

24.(18分)
 解:(1)设杆ab刚进入半圆形导轨时速度为
解:(1)设杆ab刚进入半圆形导轨时速度为 ,到达最高位置CD位置时,速度为
,到达最高位置CD位置时,速度为 ,由于恰能通过最高点,则:
,由于恰能通过最高点,则: 解得
解得
杆ab进入半圆形导轨后,由于轨道绝缘,无感应电流,则根据机械能守恒:

解得
设在最低点时半圆形轨道对杆ab的支持力为N,
则有
解得
(2)杆ab离开半圆形导轨后做平抛运动,设经时间 落到水平导轨上
落到水平导轨上
 解得
解得
则杆ab与NQ的水平距离
故EF与NQ的水平距离为
(3)设杆ab做匀减速运动的加速度为a
 解得
解得
对杆刚要到达NQ位置进行分析

25.(22分)解:(1)设所加电场沿X、Y轴的分量分别 和
和 ,粒子沿X、Y轴的加速度分量分别和
,粒子沿X、Y轴的加速度分量分别和 ,则有:
,则有:
 代入
代入 解得
解得
粒子到达P点时速度为

粒子的加速度为

(2)设粒子在框架内的圆周运动半径为R
由分析可知 解得:
解得:
由
则
(3)设从C到P运动的时间为,碰撞次数最小的情况下在磁场中运动的周期为T
则

在电场中运动的时间
在磁场中运动的时间
回到C点的时间
生物部分参考答案
一、选择题:1――6 CBADBB
二、非选择题
30.I(14分除注明外,每空2分)(1)阴生 (2)6 (3)efgh (4)4 不能(1分),因为植物一昼夜积累的有机物为零(1分) (5)不正确(1分):葡萄糖不能直接进入线粒体,必须在细胞质基质中分解为丙酮酸后,方可进入线粒体继续分解(1分) (6)光能→ATP中活跃的化学能→有机物中稳定的化学能→ATP中活跃的化学能
II(14分,每空2分)
(1)①试验要有可重复性,仅用两只小白鼠进行试验有一定的偶然性;②对照试验前首先测量甲、乙两鼠的体温。③对照组要作假性试验处理(其他合理也可给分)
(2)赞同,先做不破坏下丘脑的试验,再做破坏下丘脑后的试验,进行前后自身对照。
(3)BD(不完整不得分)
(4)甲状腺素和肾上腺素(不完整不得分)神经和体液(不完整不得分)
(5)影响甲状腺素的分泌,精神萎靡,食欲不振恶或影响抗利尿激素合成,尿液量增加。(其他合理也可给分)
31.(16分,每空2分)
(1)形状分离 高产抗病且能稳定(不完整不得分)
(2)选择
(3)不同物种间存在生殖隔离(或远源杂交不亲和的障碍)
(4)①1:1 ②抗性小麦:不抗性小麦=3:1 (不完整不得分) ③抗病基因接在含有高产基因的染色体上
(5)病原体感染
化学部分答案
7-13 BADBCCC
26.(共16分)
I (1) (1分) ;(2)弱 (1分) ;只要符合要求即可 (2分)
(1分) ;(2)弱 (1分) ;只要符合要求即可 (2分)
(3)N2H4(1)+O2(g)=N2(g)+2H2O(1), H=-629Kj/mol (3分)
H=-629Kj/mol (3分)
II (1)无论从速率还是平衡考虑,压强越大均越有利,但考虑到设备材质和加工工艺要求、生产力等综合成本等因素,实际采用30―50Mpa ,(2分)
在此温度范围内,催化剂活性最佳。(2分)
(2) (2分) (3)N2+6e-+8H+=2N
(2分) (3)N2+6e-+8H+=2N (3分)
(3分)
27.(共14分)
(1)
(2)氯碱工业 (1分) , (3分)
(3分)
(3) (2分)
(2分)  (2分) (4)
(2分) (4) (3分)
(3分)
28.(共14分)
(1)+1价, +2价, (各1分); Cu2O(2分)
(2)阴极上: (2分)
(2分)
阳极上: (白)(3分)
(白)(3分)
(3)① (3分)
(3分)
② (2分)
(2分)
29.(共14分)
(1)①②④ (2分)
(2)1,2-二溴丙烷(2分)

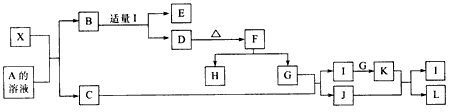
回答以下问题:
(1)写出X的化学式:_______________。
(2)写出X与A溶液反应的化学方程式:_____________写出K与J反应的化学方程式_____________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(横线上填新物质的化学式):
_______+2N2
 4X+SiC+3C。
4X+SiC+3C。 | A | |||||||||||||||||
| B | C | D | E | F | |||||||||||||
| G | H | I | J | ||||||||||||||
| K | M | L |
(1)写出上表中元素D形成单质的电子式为


(2)元素K基态原子的电子排布式


(3)元素M位于周期表的第
(4)G、H、I 这三种元素的第一电离能由大到小的顺序是
(5)元素A、D、J按照原子个数比4:1:1形成的化合物的化学式为
(6)A、C、D 形成的ACD分子中,含有
(7)E、F、G、H这四种元素原子形成的简单阴、阳离子,按半径由小到大排列
(8)某些不同族元素的性质也有一定的相似性,如上表中元素B与元素I的氢氧化物有相似的性质,写出元素B的氢氧化物与NaOH溶液反应后盐的化学式
(9)元素L在一定条件下形成的晶体的基本结构单元如图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为:

 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
(2)c、d原子半径大小c
(3)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(kJ?mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
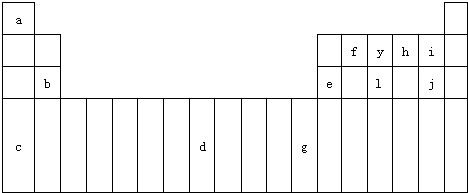
(1)请写出上述元素d基态原子的核外电子排布式
(2)请比较b、e两种元素的第一电离能大的是
(3)i与j的氢化物比较,沸点较高的是
(4)f2a2分子的结构简式是
(5)利用VSEPR理论确定y与a形成的10电子分子的理想构型是
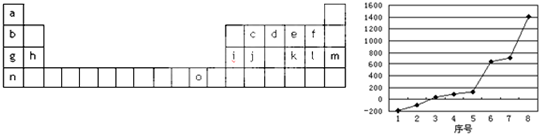
试回答下列问题:
(1)按电子排布,可把周期表中的元素划分成5个区,其中j位于
(2)请写出字母o代表的元素的基态原子外围电子排布式
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表
(4)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶体类型与晶体j相同.两者相比熔点更高的是
(5)COCl2俗称光气,分子中C原子采取
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2]分子的空间构型是