网址:http://m.1010jiajiao.com/timu_id_516107[举报]
为了贯彻“循环经济,防止污染”的理念,某校化学课外活动小组利用废干电池作为再生资源。其实验设计如下:

一、实验目的
从废旧电池中提取有用物质,并检验铵盐的纯度。
二、实验材料
废旧1号电池若干节,钳子等实验用品。
三、实验步骤
1.获取铜帽、锌片、石墨电极
2.从黑色混合物的滤液中提取NH4Cl
3.提取二氧化锰
(1)有关干电池的基本构造和工作原理如右上图。
电池总反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O,干电池工作时负极上的电极反应式为:______________;正极上产生两种气体,则正极的电极反应式为:________________。
(2)用钳子和剪子剪开回收的干电池的锌筒,把铜帽、锌皮和碳棒回收,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵和氯化锌的提取、检验和分离:
①从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物,主要包括:溶解、_________、蒸发、_________。
②设计简单的实验证明所得晶体中含有 和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn
和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn ],并填写下列实验报告。
],并填写下列实验报告。
(a)________,(b)___________,(c)__________,(d)__________,(e)__________,(f)___________。
③最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要硅酸盐质仪器除酒精灯外还有___________。
(4)晶体中氯化铵质量分数的测定:
已知 与HCHO在水溶液中有如下反应:4
与HCHO在水溶液中有如下反应:4 +6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
+6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
某学校设计了一节实验活动课,让学生从废旧电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下。回答有关问题。
(1)干电池的基本构造和工作原理如图为干电池的基本构造图。干电池工作时负极上的电极反应是__________________________,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2=Mn2O3+H2O。
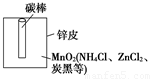
(2)锌皮和碳棒的回收用钳子和剪子剪开待回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②设计简单的实验证明所得晶体中含有NH。
实验步骤
________________________________________________________________________
________________________________________________________________________;
实验现象
________________________________________________________________________;
有关的离子方程式
________________________________________________________________________。
③用________的方法可将NH4Cl和ZnCl2的晶体混合物分离开。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中要用到的主要仪器有
________________________________________________________________________。
查看习题详情和答案>>
(14分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设 ①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)
饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②该实验装置与实验室制取下列气体相同的是 (填标号);
A、用稀盐酸和锌反应制H2 B、用MnO2和浓盐酸加热反应制C12
C、用KC1O3与MnO2共热反应制O2
(4)实验步骤
① 按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
。
(6)实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: 。
查看习题详情和答案>>
(1)如图是干电池的基本构造图,干电池工作时正极上的反应是
 则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.
则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中.
(3)氯化铵、氯化锌的提取、分离和检验.①如何从黑色粉末中提取NH4Cl和ZnCl2的晶体混合物?写出简要的实验步骤:______.
②用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?______.
③写出证明ZnCl2晶体中含Zn2+的操作步骤及实验现象:______(已知Zn(OH)2是两性氢氧化物且能溶解于氨水)
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等,可用灼烧的方法除去杂质.该实验中需要用到的主要仪器除酒精灯外,还有______.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)如图是干电池的基本构造图,干电池工作时正极上的反应是
 则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.
则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中.
(3)氯化铵、氯化锌的提取、分离和检验.①如何从黑色粉末中提取NH4Cl和ZnCl2的晶体混合物?写出简要的实验步骤:______.
②用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?______.
③写出证明ZnCl2晶体中含Zn2+的操作步骤及实验现象:______(已知Zn(OH)2是两性氢氧化物且能溶解于氨水)
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等,可用灼烧的方法除去杂质.该实验中需要用到的主要仪器除酒精灯外,还有______.
 查看习题详情和答案>>
查看习题详情和答案>>