摘要:C. D.
网址:http://m.1010jiajiao.com/timu_id_499142[举报]
1.B 2.B 3.B 4.B 5.A 6.BD 7.A 8.A 9.AD 10.A 11.AD
12.CD 13.C 14.A 15.B 16.D 17.D 18.C 19.A 20.B 21.A 22.B
23.(1)E、 、
、 (2)D、
(2)D、 、
、 (3)A、
(3)A、 、
、 (4)D、
(4)D、 、
、 .
.
24.①
②
③
④
25.(1)磺酸基 H亦有较强的酸性
H亦有较强的酸性 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
(2)A  (3)
(3)

26.(1) (2)
(2) (3)②⑤
(3)②⑤
(4)
n 

(2)①

②

(2)①②③④
29.


(2)可以,因为该反应的总反应式为 ,原子利用率=34/34×100%=100%,故可称为理想状态
,原子利用率=34/34×100%=100%,故可称为理想状态
30.(1)A、D (2)除去过量的硫粉 (3)
(4) 生成
生成 :
: ,∴ 未饱和
,∴ 未饱和
(5)B (6)设析出的晶体质量为x(g)
30×1.14-18.9=15.3(g) 
∴ x=23.1(g) www.ks5u.com
www.ks5u.com
Ⅰ.如图所示A~H为实验室常见的仪器、装置(部分固定夹持装置略去),请根据要求回答下列问题:
(1)A仪器的名称是
(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接
Ⅱ.为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸).
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是
(4)实验过程中,装置Ⅳ中的实验现象为
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象.为了达到这一实验目的,你认为应在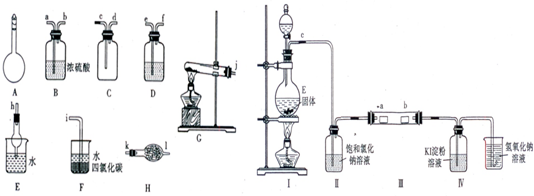
查看习题详情和答案>>
(1)A仪器的名称是
容量瓶
容量瓶
,常用于配制一定物质的量浓度的溶液
配制一定物质的量浓度的溶液
.(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接
接k、l接d、c接h或I
接k、l接d、c接h或I
.Ⅱ.为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸).
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是
用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,有液体液面高于烧瓶液面,但不流下,则气密性好
用止水夹夹住C处橡皮管,然后向分液漏斗中加水,打开分液漏斗活塞,有液体液面高于烧瓶液面,但不流下,则气密性好
.(4)实验过程中,装置Ⅳ中的实验现象为
无色液体变蓝色
无色液体变蓝色
.(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象.为了达到这一实验目的,你认为应在
Ⅱ、Ⅲ
Ⅱ、Ⅲ
之间(选填装置序号)还需添加一个洗气瓶,该装置的作用是干燥氯气
干燥氯气
.
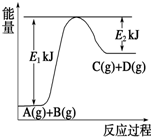 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.(1)该反应是
吸热
吸热
反应(填“吸热”或“放热”),该反应的△H=E1-E2
E1-E2
kJ?mol-1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量一定低
一定低
(填“一定高”、“一定低”或“高低不一定”).(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1
减小
减小
,E2减小
减小
,△H不变
不变
(填“增大”、“减小”或“不变”).Ⅱ.已知下列热化学方程式
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ?mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ?mol-1 ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ?mol-1③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol
CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol
.Ⅰ.在实验室利用如图1所示装置,可制备某些气体并验证其化学性质.
完成下列表格:
Ⅱ.工业上用乙烯和氯气为原料,经如图2所示各步合成聚氯乙烯(PVC):甲的结构简式是
查看习题详情和答案>>

完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制作反应的化学方程式 | ||||||
| (1) | 乙烯 | B→D→E B→D→E |
CH3-CH2-OH
CH3-CH2-OH
| ||||||
| (2) | 乙炔 | A→C→E | CaC2+2H2O=Ca(OH)2+C2H2↑ CaC2+2H2O=Ca(OH)2+C2H2↑ |
CH2Cl-CH2Cl
CH2Cl-CH2Cl
;反应(3)的化学方程式是nH2C=CHCl
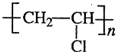 .
.
| 催化剂 |
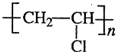 .
.nH2C=CHCl
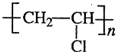 .
.
.| 催化剂 |
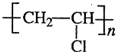 .
.Ⅰ.下列四支试管中,过氧化氢分解的化学反应速率最大的是
Ⅱ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是
(2)写出实验③的化学反应方程式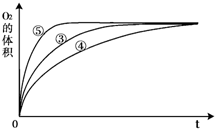
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
查看习题详情和答案>>
c
c
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
探究浓度对反应速率的影响
探究浓度对反应速率的影响
.(2)写出实验③的化学反应方程式
2H2O2 O2↑+2H2O
O2↑+2H2O
 O2↑+2H2O
O2↑+2H2O2H2O2 O2↑+2H2O
O2↑+2H2O
. O2↑+2H2O
O2↑+2H2O
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
.Ⅰ.化合物A是一种酯,它的分子式为C4H8O2,有下图转化关系.试回答下列问题.

(1)A的名称是
(2)B的结构简式是
(3)D中含有的官能团(填名称)
(4)写出B和C生成A的化学方程式
Ⅱ.聚苯乙烯是一种发泡塑料,可用于包装材料等.聚苯乙烯的结构简式为:
试回答下列问题:
(1)聚苯乙烯的单体是(写结构简式):
该单体可发生的化学反应类型有
(2)试推测聚苯乙烯是
查看习题详情和答案>>

(1)A的名称是
乙酸乙酯
乙酸乙酯
.(2)B的结构简式是
CH3COOH
CH3COOH
.(3)D中含有的官能团(填名称)
醛基
醛基
.(4)写出B和C生成A的化学方程式
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
.| 浓硫酸 |
| △ |
Ⅱ.聚苯乙烯是一种发泡塑料,可用于包装材料等.聚苯乙烯的结构简式为:

试回答下列问题:
(1)聚苯乙烯的单体是(写结构简式):
CH2=CH(C6H5)
CH2=CH(C6H5)
.该单体可发生的化学反应类型有
加聚反应、氧化反应、取代反应等
加聚反应、氧化反应、取代反应等
.(写两种)(2)试推测聚苯乙烯是
线型
线型
型分子(填“线型”或“体型”),它能否溶解于CHCl3,能
能
.(填“能”或“否”),它具有热塑性
热塑性
性(填“热塑”或“热固”).


