摘要:含Na2CO399.5%600卤素含MgCl230%310请填下列空白: (1)在步骤②中加入物质X.最佳的选择应是 . 理由是 , 步骤②中应的离子方程式为 .
网址:http://m.1010jiajiao.com/timu_id_446049[举报]
题号
1
2
3
4
5
6
7
8
答案
C
C
A
B
C
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
B
A
C
D



 + H2O
+ H2O  +HCl
+HCl 
 +NaCl
+NaCl


 +c(H+)×
+c(H+)× (或 R≥8.3)
(1分)
(或 R≥8.3)
(1分)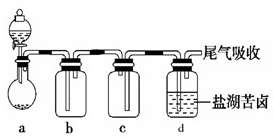 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色. (2010?上海)白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示.该结构中氯原子有两种不同位置.
(2010?上海)白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示.该结构中氯原子有两种不同位置.