摘要:“化学诗集篇 .“化学趣味史篇 和“化学魔术篇 通过调查一线教师实验教学不理想另外一个重要原因之一就是现在的很多教师修为不够,我们一线教师很多自己的知识面狭窄决定了教学视野不够开阔.课堂没有生命力.教师传授知识是单一型.只是为了教书而教知识.这样的课堂对如今见多识广的学生来说无不是一种煎熬.你有时会也会觉得乏味.所以作为一线化学教师要使自己的课堂充满活力有生命力.首先自己的不断学习.丰富自己的知识面和建构自己的知识结构. 本课题组为给一线教师一些营养剂.课题组成员查阅并整理.并通过课堂教学实践汇聚成了“化学实验诗集篇 .“化学趣味史篇 和“化学魔术篇 成果.这些都将会提高一线教师的专业素养.提升自己课堂教学内涵,这些成果若渗透到自己的日常教学中.将会不断增强自己的教学魅力指数.使自己向学者型专家型的教师走进.并将成为教育大家.都离不这些东西.
网址:http://m.1010jiajiao.com/timu_id_4437130[举报]
(2010?大连二模)[选修-化学与技术]
氟化钠是一种微溶于水的盐,实验室可通过图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
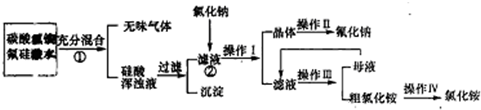
已知:20℃时氯化铵的溶解度为37.2g,Na2SiF6微溶于水,请回答下列问题:
(1)上述流程中①②分别发生化学反应,写出相关的化学方程式:
①
(2)请指出I-IV实验操作的名称;操作I
(3)操作II的具体过程是
(4)流程①中的NH4HCO3必须过量,其原因的是
查看习题详情和答案>>
氟化钠是一种微溶于水的盐,实验室可通过图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;

已知:20℃时氯化铵的溶解度为37.2g,Na2SiF6微溶于水,请回答下列问题:
(1)上述流程中①②分别发生化学反应,写出相关的化学方程式:
①
H2SiF6+6NH4HCO3═6NH4F+H2SiO3↓+6CO2↑+3H2O
H2SiF6+6NH4HCO3═6NH4F+H2SiO3↓+6CO2↑+3H2O
;②NH4F+NaCl═NaF↓+NH4Cl
NH4F+NaCl═NaF↓+NH4Cl
;(2)请指出I-IV实验操作的名称;操作I
过滤
过滤
,操作II结晶
结晶
,操作III洗涤
洗涤
,操作IV重结晶
重结晶
.(3)操作II的具体过程是
待母液全部滤出后,再向滤纸上加蒸馏水至恰好浸没晶体,静置让其滤出,重复操作2-3次,以除去晶体表面的杂质
待母液全部滤出后,再向滤纸上加蒸馏水至恰好浸没晶体,静置让其滤出,重复操作2-3次,以除去晶体表面的杂质
.(4)流程①中的NH4HCO3必须过量,其原因的是
保证H2SiF6能全部反应,防止生成Na2SiF6沉淀,混入NaF中影响NaF质量
保证H2SiF6能全部反应,防止生成Na2SiF6沉淀,混入NaF中影响NaF质量
.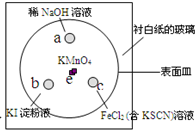 (2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.
(2011?崇明县一模)如图,化学实验的微型化可有效减少污染,实现化学实验的绿色要求.某学生在一块衬白纸的玻璃片的不同位置分别加一滴含酚酞的NaOH溶液(a)、浓度为0.1mol/L KI淀粉溶液(b)、FeCl2(含KSCN)溶液(c),并在e处放置少量KMnO4晶体,向KMnO4晶体上滴加几滴浓盐酸后立即用表面皿盖好,形成一个气室.已知反应中有关物质的转化过程为:
KMnO4→MnCl2;
HCl→Cl2
(1)e 处的化学反应方程式为
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
该反应中氧化剂与还原剂的物质的量之比为_1:5
1:5
,电子转移的数目为10
10
.(2)b处的实验现象为
溶液变蓝色
溶液变蓝色
,c处的实验现象为溶液变红色
溶液变红色
.(3)a处的反应方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)通过该实验可比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是
KMnO4>Cl2>FeCl3
KMnO4>Cl2>FeCl3
. 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.[已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O]
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.[已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O](1)e处反应的离子方程式为
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
.该反应中发生反应的氧化剂和还原剂的物质的量之比为1:5
1:5
.(2)b处的实验现象为
溶液由无色变为蓝色
溶液由无色变为蓝色
,d处的实验现象为溶液由浅绿色变为红色
溶液由浅绿色变为红色
.(3)c处反应的化学方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.标准状况下,当有0.224L Cl2被NaOH溶液吸收后,转移电子的物质的量为0.01
0.01
mol.(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
能
能
(填“能”或“不能”),若能,其氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3
KMnO4>Cl2>FeCl3
.(2009?南通二模)[化学--选修化学与技术]
磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自然.我国粮食卫生标准(GB2175-2005)规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg.
通过下列方法对粮食中残留磷化物含量进行测定.
[实验课题]粮食中残留磷化物的定量测定
[实验原理]5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
[操作流程]安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸标准溶液滴定

[实验装置]
C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4的溶液(H2SO4酸化)
(1)以磷化铝为例,写出磷化物与水反应的化学方程式
(2)检查上述装置气密性的方法是
(3)实验过程中,用抽气泵抽气的目的是
(4)A中盛装KmnO4溶液是为除去空气中可能含有的
(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为
查看习题详情和答案>>
磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自然.我国粮食卫生标准(GB2175-2005)规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg.
通过下列方法对粮食中残留磷化物含量进行测定.
[实验课题]粮食中残留磷化物的定量测定
[实验原理]5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
[操作流程]安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸标准溶液滴定

[实验装置]
C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4的溶液(H2SO4酸化)
(1)以磷化铝为例,写出磷化物与水反应的化学方程式
AlP+3H2O=Al(OH)3↓+PH3↑
AlP+3H2O=Al(OH)3↓+PH3↑
.(2)检查上述装置气密性的方法是
打开抽气泵抽气,观察各装置中是否有气泡产生
打开抽气泵抽气,观察各装置中是否有气泡产生
.(3)实验过程中,用抽气泵抽气的目的是
保证生成的PH3全部被酸性KMnO4溶液吸收
保证生成的PH3全部被酸性KMnO4溶液吸收
.(4)A中盛装KmnO4溶液是为除去空气中可能含有的
还原性气体
还原性气体
;B中盛装碱性焦性没食子酸溶液的作用是除去空气中的O2
除去空气中的O2
;如去除B装置,则实验中测得的PH3含量将偏低
偏低
.(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为
0.085
0.085
mg/kg.(2011?宝山区一模)化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按如下图所示的装置和试剂完成了一个实验.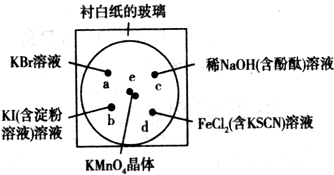
实验步骤:
①a、b、c、d四处各滴1滴如图所示的试液,浓度均为0.1mol?L-1;
②圆心e处放有2粒芝麻粒大小的KMnO4晶体,向晶体滴加1滴浓盐酸后,在试剂上盖上表面皿.
(1)e处产生黄绿色气体,写出e处发生反应的化学方程式(不用配平):
该反应中氧化剂与还原剂的物质的量之比为
(2)a处反应的离子方程式为
(3)通过该实验,能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
查看习题详情和答案>>

实验步骤:
①a、b、c、d四处各滴1滴如图所示的试液,浓度均为0.1mol?L-1;
②圆心e处放有2粒芝麻粒大小的KMnO4晶体,向晶体滴加1滴浓盐酸后,在试剂上盖上表面皿.
(1)e处产生黄绿色气体,写出e处发生反应的化学方程式(不用配平):
KMnO4
KMnO4
+HCl(浓)
HCl(浓)
→MnCl2+Cl2↑
Cl2↑
+H2O
H2O
+删除此空
删除此空
该反应中氧化剂与还原剂的物质的量之比为
1:5
1:5
.(2)a处反应的离子方程式为
2Br-+Cl2═2Cl-+Br2
2Br-+Cl2═2Cl-+Br2
;d处的实验现象为溶液变红色
溶液变红色
.(3)通过该实验,能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
能
能
(填“能”或“不能”),若能,三者氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3
KMnO4>Cl2>FeCl3
.(若认为“不能”,则此空不用填写)