摘要:3撰写结题报告. 4研究经费和保障
网址:http://m.1010jiajiao.com/timu_id_4437115[举报]
小军在实验室里做了下列实验:
①分别向盛有稀硫酸和稀盐酸的试管中,滴加紫色石蕊试液;②向盛有稀硫酸的试管中,滴加氢氧化钠试液;③向盛有锌粒的试营中,分别滴加稀盐酸和稀硫酸;④将一根生锈的铁钉分别放入盛有稀盐酸和稀硫酸的试管中,过一会儿取出。
他在纸上记录了以下现象:
a. 溶液没有明显现象;b. 溶液变为黄色;c. 溶液显红色;d. 产生气泡,溶液无色。
下面请你来整理完成实验报告。
(1)实验目的:探究__________(填写物质类别)的化学性质。
(2)实验现象:产生a现象的实验所对应的一类反应通常被我们称作__________反应(该反应属于复分解反应)。
(3)上题所涉及的这类反应在日常生活和工农业生产中有广泛的应用。请举出一个利用该反应的实例:______________________________。
查看习题详情和答案>>人们对苯及芳香烃的认识有一个不断深化的过程.
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6的两种含两个叁键且无支链链烃的结构简式

 、
、
 .
.
(2)已知分子式为 C6H6的结构有多种,其中的两种为图1,
①这两种结构的区别表现在:定性方面(即化学性质方面):(Ⅰ)不能而(Ⅱ)能
a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1mol C6H6与H2加成时:(Ⅰ)需
②今发现 C6H6还可能有另一种如图2立体结构:该结构的二氯代物有
(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断,它的结构简式如图3,可能是下列中的
(4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列
a.萘不能使溴水褪色 b.萘能与H2发生加成反应
c.萘分子中所有原子在同一平面上 d.一溴代萘(C10H7Br)只有两种
(5)现代化学认为萘分子碳碳之间的键是
 .
.
查看习题详情和答案>>
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6的两种含两个叁键且无支链链烃的结构简式




(2)已知分子式为 C6H6的结构有多种,其中的两种为图1,
①这两种结构的区别表现在:定性方面(即化学性质方面):(Ⅰ)不能而(Ⅱ)能
ab
ab
(选填a、b、c、d,多选扣分)a.被酸性高锰酸钾溶液氧化 b.与溴水发生加成反应
c.与溴发生取代反应 d.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1mol C6H6与H2加成时:(Ⅰ)需
3
3
mol,而(Ⅱ)需2
2
mol.②今发现 C6H6还可能有另一种如图2立体结构:该结构的二氯代物有
3
3
种.(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断,它的结构简式如图3,可能是下列中的
c
c
(填入编号).(4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列
a
a
事实(填入编号).a.萘不能使溴水褪色 b.萘能与H2发生加成反应
c.萘分子中所有原子在同一平面上 d.一溴代萘(C10H7Br)只有两种
(5)现代化学认为萘分子碳碳之间的键是
介于单键与双键之间的独特的键
介于单键与双键之间的独特的键
;根据第(4)小题中萘的性质及我们学过的苯的结构简式推测,请你写出你认为的萘的结构简式


(2013?杭州一模)某种甲酸酯水解反应方程式为:
HCOOR(l)+H2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
甲酸酯转化率在温度T1下随反应时间(t)的变化如图:
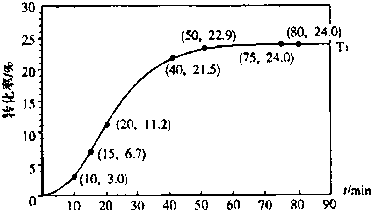
根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
(1)该反应的平衡常数K 的表达式
(不要求计算);T1温度下平衡体系中.c(ROH )为
(2)15~20min范围内用甲酸酯表示的平均反应速率为
(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
查看习题详情和答案>>
HCOOR(l)+H2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
| 组分 | HCOOR | H2O | HCOOH } | ROH |
| 物质的量浓度/mol?L-1’ | 1.00 | 1.99 | 0.01 | 0.52 |

根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
| 反应时间/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均速率/10-3mol?L-1?min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
0.76
0.76
mol?L一1(2)15~20min范围内用甲酸酯表示的平均反应速率为
0.009
0.009
mol?L-1?min-1,(不要求写出计算过程).(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
催化剂
催化剂
的作用.在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2?2NH3 △H<0
(1)当反应达到平衡时,N2和H2的浓度比是
(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量
(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将
(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将
(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
查看习题详情和答案>>
(1)当反应达到平衡时,N2和H2的浓度比是
1:3
1:3
.(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量
减少
减少
,密度不变
不变
.(填增大、减少或不变,第3~6题填“正向”、“逆向”或“不”)(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将
不
不
移动.(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将
逆向
逆向
移动.(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将
逆向
逆向
移动.(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
正向
正向
移动.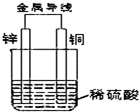 (1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)
(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)  4NO2(g)+O2(g).反应5min后,测得N2O5转化了20%,则:υ(NO2)为
4NO2(g)+O2(g).反应5min后,测得N2O5转化了20%,则:υ(NO2)为0.16mol/(L?min)
0.16mol/(L?min)
、5min时,N2O5占混合气体体积分数是61.5%
61.5%
.阅读资料,回答(2)、(3)小题锌铜原电池用画图的方式(如图)表示很不方便,常常采用电池图式表达式,如Zn|ZnSO4(1mol/L)||CuSO4(1mol/L)|Cu 上式中,发生氧化反应的负极写在左边,发生还原反应的正极写在右边.用实垂线“|”表示电极与溶液之间的界面,用双实垂线“||”表示盐桥.(2)上述资料列举的电池中,锌片上发生的电极反应式是
Zn-2e-=Zn2+
Zn-2e-=Zn2+
,(3)现有一电池,其图式表达式为Cu|CuSO4(1mol/L)||Fe2(SO4)3(0.5mol/L)|C.该电池中,正极的电极反应式是
2Fe3++2e-=2Fe2+
2Fe3++2e-=2Fe2+
,负极的电极反应式是Cu-2e-=Cu2+
Cu-2e-=Cu2+
.(4)写出支链只有一个乙基且式量最小的烷烃的结构简式

