摘要:(二)溶液的pH 1.酸性溶液:按C→CH+→pH 2.碱性溶液:按C→COH-→CH+→pH 3.强酸.强碱溶液的稀释后的溶液:对于酸溶液中的CH+.每稀释10n倍.pH增大n个单位.但增大后不超过7.酸仍为酸! ①对于碱溶液中的COH-.每稀释10 n倍.pH减少n个单位.但减少后不小于7.碱仍为碱! ②pH值相同的强酸与弱酸.稀释相同的倍数.pH变化为强酸变化大.弱酸变化小. ③极稀溶液中的pH值的计算.应考虑水的电离. 4.强酸与强弱溶液混合的计算: 反应的实质:H++OH-=H2O 三种情况:若余酸.先求中和后的CH+.再求pH. (3)若余碱.先求中和后的COH-.再通过KW求出CH+.最后求pH. 5.已知酸和碱溶液的pH之和.判断等体积混合后的溶液的p H (1)若强酸与强碱溶液的pH之和大于14.则混合后显碱性.pH大于7. (2)若强酸与强碱溶液的pH之和等于14.则混合后显中性.pH等于7. (3)若强酸与强碱溶液的pH之和小于14.则混合后显酸性.pH小于7. (4)若酸与碱溶液的pH之和等于14.强.碱中有一强.一弱.则酸.碱溶液混合后.谁弱显谁性.这是因为酸和碱已电离的H+ 和OH- 恰好中和.谁弱谁的H+ 或OH- 有储备.中和后还能电离.显出酸.碱性来. 第1课时 强弱电解质 教材在讲述电解质的有关概念时.跨度较大.必修1的第二章第二节讲述了电解质的概念.选修第三章第一节.第二节讲述了强.弱电解质的有关概念.
网址:http://m.1010jiajiao.com/timu_id_4437052[举报]
(2012?泉州二模)已知甲和乙在溶液中的转化关系如图1所示:
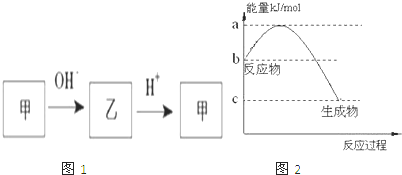
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为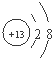
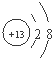 .
.
(2)若甲是10电子的阳离子,乙是碱性气体.1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如图2:写出乙的一种用途:
(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:CrO42-(黄色)+2H+? Cr2O72-(橙色)+H2O若测得甲溶液的pH=1,该溶液显
(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是
A.Fe2+ B.HCO3- C.Ba2+ D.Fe3+
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,则HCO3-的电离平衡常数Ka=
查看习题详情和答案>>

请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的结构示意图为
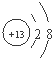
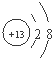
(2)若甲是10电子的阳离子,乙是碱性气体.1mol乙通入足量强酸溶液中与H+反应,反应过程中能量变化如图2:写出乙的一种用途:
制氮肥
制氮肥
;该反应的热化学方程式是NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1
NH3(g)+H+(aq)═NH4+(aq)△H=-(b-c)kJ?mol-1
.(3)若甲是CrO42-(黄色)和Cr2O72-(橙色)的混合溶液,在该溶液中存在如下平衡:CrO42-(黄色)+2H+? Cr2O72-(橙色)+H2O若测得甲溶液的pH=1,该溶液显
橙
橙
色.(4)若甲仅含有NO3-、SO42-和X三种离子,则X离子可能是
D
D
(填序号).A.Fe2+ B.HCO3- C.Ba2+ D.Fe3+
(5)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=10,则HCO3-的电离平衡常数Ka=
10-10
10-10
.(2013?宝鸡二模)有9.7g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24L.将溶液稀释为1L,测得溶液的pH=1,此时溶液中NO-3的浓度为( )
查看习题详情和答案>>
(2010?卢湾区二模)把一定量的铁和硫化亚铁的混合物与100mL 2mol/L的硫酸充分反应后,固体完全溶解,同时生成气体Y 3.36L(在标准状况下).将反应后的溶液稀释到1L,测得溶液的pH=1,则下列叙述一定正确的是( )
查看习题详情和答案>>
(2009?徐汇区二模)有一瓶用硫酸酸化的FeSO4溶液,置于空气中一段时间后,溶液的pH=1.为测定其中Fe2+被氧化的百分率,进行如下操作:
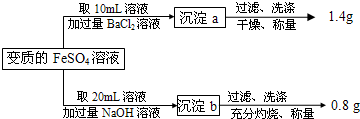
请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
(2)计算原溶液中Fe2+被氧化的百分率;
(3)原溶液中硫酸的物质的量浓度为
查看习题详情和答案>>

请计算(忽略Fe2+、Fe3+的水解):
(1)20mL变质的FeSO4溶液中,铁元素的总的物质的量为
0.01 mol
0.01 mol
;(2)计算原溶液中Fe2+被氧化的百分率;
(3)原溶液中硫酸的物质的量浓度为
0.1mol/L
0.1mol/L
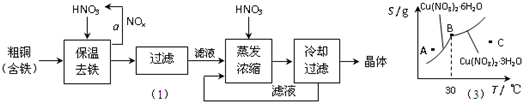
.(2009?东城区二模)(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
不用加水的方法调节溶液pH的原因是
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是
(3)图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2?nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2?3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
查看习题详情和答案>>
①在步骤a中,还需要通入氧气和水,其目的是
提高原料的利用率,减少污染物的排放
提高原料的利用率,减少污染物的排放
.②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
3.2~4.7
3.2~4.7
范围.| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
加水会将溶液稀释,不利于将滤液蒸发浓缩
加水会将溶液稀释,不利于将滤液蒸发浓缩
.③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)
由于Cu2+发生水解;Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
由于Cu2+发生水解;Cu2++2H2O?Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
.(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是
Cu2++2e-=Cu
Cu2++2e-=Cu
.(3)图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2?nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是
b d
b d
(填字母).a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2?3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2?6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是N2O4?NO++NO3-
N2O4?NO++NO3-
;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是Cu+2N2O4=Cu(NO3)2+2NO↑
Cu+2N2O4=Cu(NO3)2+2NO↑
.