摘要:电离平衡常数 ??(1)概念:在一定条件下.弱电解质的电离达到平衡时.溶液中电离所产生的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是一个常数.这个常数叫做电离平衡常数.用K表示(酸用 表示.碱用 表示). ??(2)表示方法: ??(3)K的意义:K值越大.表示该电解质较易电离.所对应的弱酸弱碱较强.从 或 的大小.可以判断弱酸和弱碱的相对强弱.例如弱酸的相对强弱: > > > > > > > ??(4)影响K值大小的因素:K值不随浓度而变化.但随温度而变化. ??(5)多元弱酸的电离.多元弱酸是分步电离的.且越向后的电离越困难.其电离出来的离子浓度也越小.酸性主要由第一步电离决定.如 的电离: ??第一步电离: ??第二步电离: ??第三步电离: ??显然: .在磷酸溶液中.由 电离出来的离子有H+.H2PO4 -.HPO4 2-.PO4 3-等离子.其离子浓度的大小关系为: .
网址:http://m.1010jiajiao.com/timu_id_4437050[举报]
(2013?海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
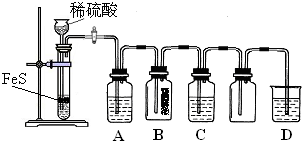
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
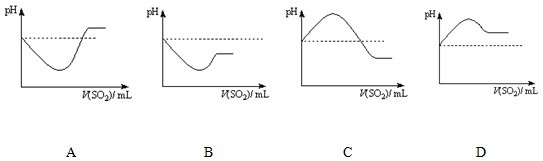
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
查看习题详情和答案>>
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
H2S+CuSO4=CuS↓+H2SO4
H2S+CuSO4=CuS↓+H2SO4
.②B中的现象是
蓝色石蕊试纸变红
蓝色石蕊试纸变红
.③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
H2S+2Fe3+=S↓+2H++2Fe2+
H2S+2Fe3+=S↓+2H++2Fe2+
.④D中盛放的试剂可以是
d
d
(填标号).a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
酸性(或酸性较强)
酸性(或酸性较强)
条件下,+4价硫的化合物可以氧化-2价硫的化合物.②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
C
C
(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
.(2010?漳州二模)25℃时,有关弱酸的电离平衡常数如下:下列有关说法正确的是( )
|
查看习题详情和答案>>
 已知某温度下,CH3COOH的电离平衡常数K=1.6×10-5.该温度下向20mL0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L KOH溶液,溶液pH变化的曲线如图所示(忽略温度变化).
已知某温度下,CH3COOH的电离平衡常数K=1.6×10-5.该温度下向20mL0.01mol/L CH3COOH溶液中逐滴加入0.01mol/L KOH溶液,溶液pH变化的曲线如图所示(忽略温度变化).