摘要:(一)学生准备 预习:第四节-海水中的化学元素.重点思考“交流·研讨 中所提出的问题.
网址:http://m.1010jiajiao.com/timu_id_4435119[举报]
阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
Fe3+的转化时,Fe3+作
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为
(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆.其中富含维生素C的食物为
(5)小芳同学在这次晚饭中食用了2g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg).
(设每千克加碘食盐中含KIO340mg,计算结果保留两位小数)
查看习题详情和答案>>
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
| 常温 |
氧化剂
氧化剂
剂(填“氧化剂”或“还原剂”);(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
还原
还原
剂;(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
;(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆.其中富含维生素C的食物为
辣椒
辣椒
,食醋中常用的防腐剂为苯甲酸
苯甲酸
,小华同学为了证明该食堂所提供的牛奶中没有添加米汤,他应该做的实验以及观察到的现象为取少量牛奶,向其中加入碘水,不变为蓝色
取少量牛奶,向其中加入碘水,不变为蓝色
;(5)小芳同学在这次晚饭中食用了2g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg).
(设每千克加碘食盐中含KIO340mg,计算结果保留两位小数)
(2012?醴陵市模拟)实验室有一包暗红色粉末样品可能是CaCO3、Fe2O3或FeO的混合物.后经测定已确定不存在FeO.
I.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用如图各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.
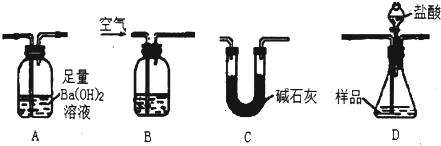
请根据题意回答下列问题:
(1)装置的连接顺序是
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是
(3)下列各项措施中,能提高测定准确度的是
a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将
查看习题详情和答案>>
I.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是
KMnO4溶液、稀硫酸
KMnO4溶液、稀硫酸
,请你描述实验操作时的步骤、实验现象和结论:取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO
取少量样品溶于试管中,配成溶液后,再滴入几滴稀硫酸和几滴KMnO4溶液,只要溶液不褪色或不变浅,即说明样品中无FeO
.Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用如图各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.

请根据题意回答下列问题:
(1)装置的连接顺序是
BDAC
BDAC
(填字母,每个装置只能用一次)(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是
将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收
将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收
(3)下列各项措施中,能提高测定准确度的是
ad
ad
(填标号)a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为
61.5%
61.5%
.(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将
偏低
偏低
(填“偏高”、“偏低”、“不变”)
阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+ Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);
Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作______剂;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为______;
(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆.其中富含维生素C的食物为______,食醋中常用的防腐剂为______,小华同学为了证明该食堂所提供的牛奶中没有添加米汤,他应该做的实验以及观察到的现象为______;
(5)小芳同学在这次晚饭中食用了2g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg).
(设每千克加碘食盐中含KIO340mg,计算结果保留两位小数)
查看习题详情和答案>>
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
 Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);
Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作______剂;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的化学方程式为______;
(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆.其中富含维生素C的食物为______,食醋中常用的防腐剂为______,小华同学为了证明该食堂所提供的牛奶中没有添加米汤,他应该做的实验以及观察到的现象为______;
(5)小芳同学在这次晚饭中食用了2g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg).
(设每千克加碘食盐中含KIO340mg,计算结果保留两位小数)
查看习题详情和答案>>
实验室有一包暗红色粉末样品可能是CaCO3、Fe2O3或FeO的混合物。后经测定已确定不存在FeO。
Ⅰ.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是_________,请你描述实验操作时的步骤、实验现象和结论:_____________________。
Ⅱ.测定混合物中Fe2O3的含量实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用题图中各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.
Ⅰ.某学生想自己设计实验方案,以证明样品中确实没有FeO.除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液和双氧水.你认为要完成该实验所选择的试剂是_________,请你描述实验操作时的步骤、实验现象和结论:_____________________。
Ⅱ.测定混合物中Fe2O3的含量实验室可用多种方法测出上述样品中Fe2O3的质量分数.现有学生准备用题图中各装置按一定顺序连接成一套完整的组合装置来进行实验以测定Fe2O3的质量分数.

请根据题意回答下列问题:
(1)装置的连接顺序是_________(填字母,每个装置只能用一次)
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是_________________
(3)下列各项措施中,能提高测定准确度的是__________(填标号)
a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为__________
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将______(填“偏高”、“偏低”、“不变”)
查看习题详情和答案>>
(1)装置的连接顺序是_________(填字母,每个装置只能用一次)
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还有一个重要作用是_________________
(3)下列各项措施中,能提高测定准确度的是__________(填标号)
a.在加入盐酸之前,应该排尽装置内的CO2气体
b.快速加入盐酸
c.在B中装入浓硫酸
d.在B中装入NaOH溶液
e.D之后增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验室准确称取26.0g固体样品装入D中,充分反应后,测得A中沉淀质量为19.7g,则样品中Fe2O3的质量分数为__________
(5)在进行实验方案评价时,有学生认为不必测定A中的沉淀质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将______(填“偏高”、“偏低”、“不变”)
 Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);
Fe3+的转化时,Fe3+作______剂(填“氧化剂”或“还原剂”);