摘要:与酸反应:NH3+HCl=NH4Cl NH3+HNO3=NH4NO3 2NH3+H2SO4=(NH4)2SO4
网址:http://m.1010jiajiao.com/timu_id_4435058[举报]
(2013?临沭县模拟)氨既是实验室中常用试剂,也是工业上重要原料.
(1)某学习小组欲制备少量的氨水.供选用的试剂有:①NH4Cl ②(NH4)2CO3.提供的装置如下:
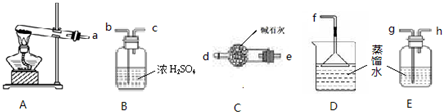
请回答下列问题:
①装置A试管内发生反应的化学方程式为
②从提供的仪器中选择并组装一套本实验的合理、简洁装置,按气流方向连接顺序为(用图中标注的导管口符号表示)a→
(2)氨在氧气中燃烧,生成水和一种单质.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-572kJ?mol-1
试写出氨在氧气中燃烧生成液态水和气态单质的热化学方程式
(3)在一定条件下,将1molN2和3molH2混合于一个10L的密闭容器中发生反应N2+3H2
2NH3,5min后达到平衡,平衡时氨的体积分数为25%.
①该反应的平衡常数表达式
②从反应开始到平衡时,N2的反应速率v(N2)=
③H2的转化率为
(4)为检验氨气与酸反应得到的某种常见氮肥的成分,某同学进行了以下实验:①加热氮肥样品产生气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊.②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化.由此可知该氮肥的主要成分可能是
A.NH4Cl B.(NH4)2CO3 C.NH4HCO3 D.NH4NO3.
查看习题详情和答案>>
(1)某学习小组欲制备少量的氨水.供选用的试剂有:①NH4Cl ②(NH4)2CO3.提供的装置如下:

请回答下列问题:
①装置A试管内发生反应的化学方程式为
(NH4)2CO3
2NH3↑+CO2↑+H2O
| ||
(NH4)2CO3
2NH3↑+CO2↑+H2O
| ||
②从提供的仪器中选择并组装一套本实验的合理、简洁装置,按气流方向连接顺序为(用图中标注的导管口符号表示)a→
edf
edf
.(2)氨在氧气中燃烧,生成水和一种单质.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-572kJ?mol-1
试写出氨在氧气中燃烧生成液态水和气态单质的热化学方程式
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2kJ?mol-1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2kJ?mol-1
.(3)在一定条件下,将1molN2和3molH2混合于一个10L的密闭容器中发生反应N2+3H2
| 催化剂 |
| 高温高压 |
①该反应的平衡常数表达式
K=
| c2(NH3) |
| c(N2)?c3(H2) |
K=
.| c2(NH3) |
| c(N2)?c3(H2) |
②从反应开始到平衡时,N2的反应速率v(N2)=
0.008mol/(L﹒min)
0.008mol/(L﹒min)
.③H2的转化率为
40%
40%
.(4)为检验氨气与酸反应得到的某种常见氮肥的成分,某同学进行了以下实验:①加热氮肥样品产生气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊.②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化.由此可知该氮肥的主要成分可能是
C
C
.A.NH4Cl B.(NH4)2CO3 C.NH4HCO3 D.NH4NO3.
按要求填空.
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
Ⅱ:(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因
(2)稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应
III:依据氧化还原反应:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1mol?L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00mL
(1)如何知道滴定到达终点?
(2)下列操作会导致测定结果偏低的是
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(3)下列每种量器的数量不限,在上述实验中,必须使用的有
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管 E容量瓶
(4)FeSO4的质量分数为
查看习题详情和答案>>
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
N2(g)+3H2(g)═2NH3(g)△H=-92kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92kJ?mol-1
Ⅱ:(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因
Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊
Cu2+水解产生Cu(OH)2是吸热反应,加热促进水解,故产生浑浊
如何才能用热水配制出澄清的较浓的CuSO4溶液应加入少量H2SO4
应加入少量H2SO4
;(2)稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
III:依据氧化还原反应:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1mol?L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00mL
(1)如何知道滴定到达终点?
溶液由浅绿色变为紫红色,且半分钟后不变色
溶液由浅绿色变为紫红色,且半分钟后不变色
(2)下列操作会导致测定结果偏低的是
C
C
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(3)下列每种量器的数量不限,在上述实验中,必须使用的有
ABDE
ABDE
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管 E容量瓶
(4)FeSO4的质量分数为
50%
50%
.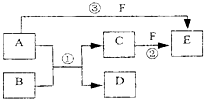 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和 D相遇有白烟生成.
(1)反应③的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
(2)反应①中每生成1mol C,转移的电子数为
3.612×1024
3.612×1024
;(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈
酸
酸
性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写:①c(H+)+
c(NH4+)
c(NH4+)
=c(OH-)+c(Cl-)
c(Cl-)
;②c(H+)=c(OH-)+
c(NH3?H2O)
c(NH3?H2O)
.(4)元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;②X、空气、海水可以组成新型海水标志灯的电池.该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.则该新型电池的正极的电极反应式为
O2+H2O+4e-=4OH-
O2+H2O+4e-=4OH-
;原电池的总反应方程式为4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
.