网址:http://m.1010jiajiao.com/timu_id_4435011[举报]
(20分)A物质是实验室一种无色有毒的挥发性液体,由X、Y两种短周期元素组成。A在空气中极易着火生成B气体和C气体;A不溶于水,但加热到423K可以和水反应,生成B气体和D气体,D只含两种元素,其中一种是Y。在交流放电的情况下,分解生成E气体、F固体两种物质,E物质和B化学式量几乎相等,含Y元素约72.7%;F是环状单质分子,具有冠状结构,易溶于A,F的式量约是C的4倍。E可在液氮条件下与HBr于77K生成含双键结构的物质G,冷却至室温可得G的环状三聚体H。
6-1 写出A、B、C、D、E、F、G、H的结构简式。
6-2 用X射线衍射法测得F的晶体为正交晶系,晶胞参数a=1048pm,b=1292pm,c=2455pm。已知该物质的密度为2.07g?cm-3。计算每个晶胞中F分子的数目。
6-3 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。除了碳原子团簇之外,其它元素的原子团簇是否也具有类似碳原子团簇的奇异的特性,这是个十分有趣的研究课题。F物质有很多同分异构体,在实验手段受到各种条件的限制时,理论研究是一种重要的补充。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种X具有2次对称轴,以及两个包含对称轴的对称面,一配位和三配位原子数目相等;另外一种Y是一种椅式结构原子团簇增加2个原子形成,也具有二次对称轴,对称面和对称轴垂直。请画出这两种结构的原子团簇。
6-4 五氟化砷AsF5(2.93g)和上述物质F(0.37g)用四氮化四硫S4N4(0.53g)在液态SO2溶剂中发生完全的反应,溶剂和挥发性产物被泵抽出后得黄色固体残留物L(3.08g),分析J知其含有:As 28.04%,F 42.70%,N 5.25%,经分析L是离子化合物,阴离子为正八面体结构,阳离子为两种元素组成,结构是直线形。固体L(0.48g)溶于液态二氧化硫,和叠氮化铯Cs+N3-(0.31g)完全反应,收集应释放出得氮气于66.5kPa、298K为67.1cm3。反应混合物过滤得难溶蓝黑色纤维状固体J(0.16g)。分析J知其含有2种元素,其中含N 30.3%。红外光谱、X射线粉末衍射结果表明抽出SO2后残留物是六氟砷(V)酸铯。
(1)L的实验式是什么?
(2)提出L的结构式;
(3)写出配平的生成L的方程式;
(4)1mol L发生转化时生成氮气的物质的量;
(5)J的化学式;
(6)写出n mol L生成J的普遍离子方程式。
查看习题详情和答案>>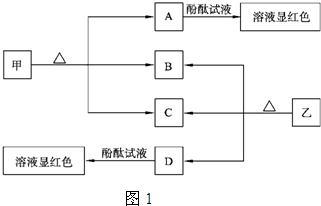
(1)甲的俗名是
(2)A、D物质的水溶液分别滴入酚酞试液后,溶液均显红色,说明溶液均显
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方程式:
II、甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g)→CH3OH(g).
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
②下列各项中,不能够说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2mol CO,同时生成1mol CH3OH
(2)图2是该反应在不同温度下CO的转化率随时间变化的曲线.
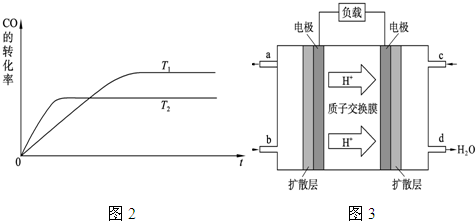
①该反应的焓变△H
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加甲醇产率的是
a.升高温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1
③H2O(g)=H2O(l)△H=-c kJ?mol-1
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图3所示.
①该电池工作时,b口通入的物质为
②该电池正极的电极反应式为: