摘要:(一)知识与技能的重.难点 电离及电解质概念.电解质在水溶液中反应的实质.离子反应.常见酸.碱.盐的电离方程式及简单离子方程式的书写.
网址:http://m.1010jiajiao.com/timu_id_4434939[举报]
如图是某学生设计的实验室制取纯净干燥的氯气的装置图,请回答下列问题:
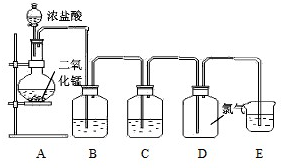
(1)装置B的作用是: 装置C的作用是: .
(2)下列物质中只有一种与干燥的氯气接触不会发生颜色变化,该物质是: .
A.湿润的蓝色石磊试纸 B.品红溶液
C.湿润的淀粉碘化钾试纸 D.干燥的红色布条
(3)为了吸取多余的氯气,防止污染空气.装置E中通常盛 溶液(填“NaOH”或“H2SO4”)
查看习题详情和答案>>

(1)装置B的作用是:
(2)下列物质中只有一种与干燥的氯气接触不会发生颜色变化,该物质是:
A.湿润的蓝色石磊试纸 B.品红溶液
C.湿润的淀粉碘化钾试纸 D.干燥的红色布条
(3)为了吸取多余的氯气,防止污染空气.装置E中通常盛
(2007?德阳模拟)有 X、Y、Z 三种常见元素.已知:X2一、Y一均与 Y 的气态氢化物分子具有相同的电子数; Y 原子的电子层数为 n,最外层电子数为 2n+1,原子核内质子数为2n2-1; Z与 Y 可形成化合物 ZY3.请回答:
(1)Y 元素在周期表中的位置是
(2)将 ZY3 溶液滴入沸水可得红褐色液体,光束通过该液体时形成光亮的“通路”,则该液体插入电极通以直流电后,与电源
(3)若将22.4g 铜和Z 2O3的混合物粉末加入到过量的 l mol?L-1H2SO4中,使之充分反应.设反应后溶液体积为 1 L,并测得此溶液中Z2+的浓度为 0.1mol?L-1,则原混合物中含有铜的质量是
查看习题详情和答案>>
(1)Y 元素在周期表中的位置是
第三周期第ⅦA族
第三周期第ⅦA族
X2一水解的离子方程式是S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
.(2)将 ZY3 溶液滴入沸水可得红褐色液体,光束通过该液体时形成光亮的“通路”,则该液体插入电极通以直流电后,与电源
负
负
(填“正”或“负”)极相连的一极附近液体颜色加深.ZY3溶液滴入沸水中反应的离子方程式是Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
.
| ||
(3)若将22.4g 铜和Z 2O3的混合物粉末加入到过量的 l mol?L-1H2SO4中,使之充分反应.设反应后溶液体积为 1 L,并测得此溶液中Z2+的浓度为 0.1mol?L-1,则原混合物中含有铜的质量是
3.2g或14.4g
3.2g或14.4g
.有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol?L-1NaOH溶液反应,用去35mL碱液时恰好完全中和.试求:混合液中H2SO4、HNO3的物质的量浓度各是多少?
查看习题详情和答案>>
碘是一种与人的生命活动密切相关的元素,已知碘单质能溶于NaOH或KI溶液,反应方程式分别为:I2+6OH-=5I-+IO3-+3H2O(HIO也不稳定易发生类似反应)和I2+I-=I3-,溴化碘(IBr)是一种卤素互化物,具有与卤素单质类似的性质,下列反应方程式正确的是( )
| A、IBr加入Na2S溶液中产生淡黄色浑浊:IBr+S2-=I-+Br-+S↓ | B、少量IBr加入KI溶液中:IBr+I-=Br-+I2 | C、IBr加入NaOH溶液中:IBr+2OH-=I-+BrO-+H2O | D、IBr加入AgNO3溶液中:3IBr+3Ag++3H2O=3AgBr↓+3IO-+6H+ |