摘要:按照课本P33图2-1-4的图示.按下列要求各举一例.并写出化学方程式. (1)制备一种物质. (2)鉴别两种物质. (4)有两种物质组成的混合物.提纯一种物质. 第3课时 引入新课-- 联想·质疑 在天气晴朗的情况下.当你漫步在茂密的树林里.会看到缕缕霞光穿过林木枝叶铺洒在地面上.你知道这是为什么吗? 在晚上.当你打开手电筒时.会看到一道“光柱 射向天空或射向远方.你知道这是为什么吗? 这些现象与一种特殊的混合物有关.
网址:http://m.1010jiajiao.com/timu_id_4434923[举报]
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1
在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.
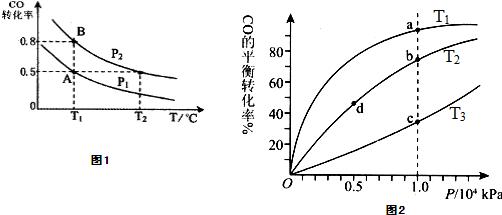
(1)T1℃反应的平衡常数为 .
(2)图中P1 P2(填“>”、“<”或“=”).
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)= L.
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是 (填字母,下同).
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是 .
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式 .
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式: .
查看习题详情和答案>>
在一容积可变的密闭容器中充入10mol CO 和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A 时,容器的体积为20L.

(1)T1℃反应的平衡常数为
(2)图中P1
(3)如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
(4)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)=v正(H2) D.容器中混合气体的平均相对分子质量保持不变
(5)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1<T2<T3
B.正反应速率:v(a)>ν(c); v(b)>v(d)
C.平衡常数:K(a)=K(c); K(b)>K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(6)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式
(7)以甲醇、CO2、空气、熔融盐K2CO3组成燃料电池,写出该电池负极的电极反应式:
Ⅰ.实验室使用容量瓶来配制一定体积、一定浓度的溶液.现在实验室需要0.10mol?L-1NaOH溶液450mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙外,还需要的仪器有
(2)根据计算得知,需称取NaOH固体的质量为
(3)配制过程中有几个关键的步骤和操作如图1所示,将实验步骤A-F按实验过程先后次序排列
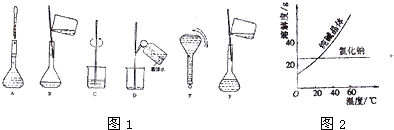
(4)配制一定物质的量浓度溶液的实验中,下列操作会导致溶液浓度偏高的是
A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中
C.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
D.定容时仰视容量瓶刻度线
Ⅱ.阅读、分析下列两个材料:
材料一:如图2
材料二:
根据上述材料及课本知识,回答下列问题(填写序号):
A.蒸馏法B.萃取法C.“溶解、结晶、过滤”的方法D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
(2)将乙二醇和丙三醇相互分离的最佳方法是
Ⅲ.有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3中的一种或几种,现按下列步骤进行实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见火焰呈紫色.由上述现象推断:该混合物中一定含有
查看习题详情和答案>>
(1)实验中除了托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙外,还需要的仪器有
500mL容量瓶
500mL容量瓶
.(2)根据计算得知,需称取NaOH固体的质量为
2.0
2.0
g.(3)配制过程中有几个关键的步骤和操作如图1所示,将实验步骤A-F按实验过程先后次序排列
CBDFAE
CBDFAE
.
(4)配制一定物质的量浓度溶液的实验中,下列操作会导致溶液浓度偏高的是
B
B
.A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中
C.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
D.定容时仰视容量瓶刻度线
Ⅱ.阅读、分析下列两个材料:
材料一:如图2
材料二:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 | 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 | 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.蒸馏法B.萃取法C.“溶解、结晶、过滤”的方法D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
C
C
;(2)将乙二醇和丙三醇相互分离的最佳方法是
A
A
.Ⅲ.有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3中的一种或几种,现按下列步骤进行实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见火焰呈紫色.由上述现象推断:该混合物中一定含有
Na2CO3、Na2SO4、Ba(NO3)2
Na2CO3、Na2SO4、Ba(NO3)2
;一定不含有CuCl2、K2CO3
CuCl2、K2CO3
;可能含有NaCl
NaCl
.酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.表格中给出了一些物质的物理常数,请回答下列问题:
(1)乙酸乙酯的实验室制法常采用如下反应:

CH3COOH+C2H5OH
CH3COOC2H5+H2O
图1为课本上制取乙酸乙酯的实验装置图,
①在制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有:增大乙醇的浓度;使用浓硫酸作催化剂和吸水剂,使平衡正向移动;
②在装置B部分,导管不能伸入溶液中的原因是
③反应结束后从所得混合溶液中分离出乙酸乙酯所用的仪器是
(2)实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了图2所示装置(画图时省略了铁夹、导管等仪器):
①实验室制备苯甲酸甲酯的化学方程式为:
 .
.
②此装置中的冷凝管起着冷凝回流的作用,水流应从
查看习题详情和答案>>
| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

CH3COOH+C2H5OH
| 浓H2SO4 |
| △ |
图1为课本上制取乙酸乙酯的实验装置图,
①在制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有:增大乙醇的浓度;使用浓硫酸作催化剂和吸水剂,使平衡正向移动;
不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率
不断小火加热蒸出产品乙酸乙酯(三者中其沸点最低),使平衡不断正向移动,提高原料利用率
等.②在装置B部分,导管不能伸入溶液中的原因是
防止倒吸
防止倒吸
;用饱和Na2CO3溶液而不用NaOH溶液来接收乙酸乙酯的原因是NaOH溶液会使乙酸乙酯水解
NaOH溶液会使乙酸乙酯水解
.③反应结束后从所得混合溶液中分离出乙酸乙酯所用的仪器是
分液漏斗
分液漏斗
,因乙酸乙酯易挥发,所以在振荡操作过程中要注意放气操作
放气操作
.(2)实验室用苯甲酸和甲醇反应制取苯甲酸甲酯时用了图2所示装置(画图时省略了铁夹、导管等仪器):
①实验室制备苯甲酸甲酯的化学方程式为:


②此装置中的冷凝管起着冷凝回流的作用,水流应从
a
a
口进入冷凝效果好(选填“a”或“b”);试简要分析实验室制取苯甲酸甲酯为什么不同样使用制取乙酸乙酯的装置的原因:原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
原料甲醇的沸点低于苯甲酸甲酯的沸点,如果还是使用制备乙酸乙酯的发
生装置,首先会使原料大量蒸馏出去,实验效率大大降低
.生装置,首先会使原料大量蒸馏出去,实验效率大大降低
 (2010?南宁二模)某化学兴趣小组在按图1装置做钠在空气中燃烧的实验时,观察到产物不仅仅有淡黄色的固体生成,还有少量的黑色颗粒产生,该小组对黑色颗粒进行了如下探究:
(2010?南宁二模)某化学兴趣小组在按图1装置做钠在空气中燃烧的实验时,观察到产物不仅仅有淡黄色的固体生成,还有少量的黑色颗粒产生,该小组对黑色颗粒进行了如下探究:(1)甲同学查阅资料知:钠与二氧化碳反应生成一种钠的正盐和一种黑色颗粒.据此推测黑色颗粒是
炭黑
炭黑
.写出生成该黑色颗粒的化学方程式:4Na+3CO2
2Na2CO3+C
| ||
4Na+3CO2
2Na2CO3+C
.
| ||
(2)乙同学认为只要将上述实验稍作改进,即可证明甲同学的猜想是否合理,请在图2的方框中画出装置图并注明相关药品的名称.
(3)丙同学按照乙同学的实验方案进行实验后,仍发现微量的黑色固体,于是认为可能是金属钠含有其它杂质,他发现在保存钠的试剂瓶的标签上有如下内容:
| 元素符号:Na纯度:89% 相对原子质量:22.99 磷酸盐-0.001% 硫酸盐-0.002% 铁-0.002% |
| 实验步骤 | 实验现象及结论 |
| ①收集上述微量黑色固体于试管中, 滴加过量的稀硫酸 滴加过量的稀硫酸 ②取少量反应后的溶液于试管中,滴加KSCN溶液 取少量反应后的溶液于试管中,滴加KSCN溶液 |
炭黑和铁的氧化物
炭黑和铁的氧化物
(填名称).
H2O2是实验室常用的一种化学试剂.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是 ,实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是 .
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图能1够得出的实验结论是 .

Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图2所示的实验装置进行实验.
(1)实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,则实验中需要测量的数据是 .
(2)加入0.1g mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.解释反应速率变化的原因 ,计算H2O2的初始物质的量浓度 .(保留两位有效数字)
查看习题详情和答案>>
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图能1够得出的实验结论是

Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如图2所示的实验装置进行实验.
(1)实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,则实验中需要测量的数据是
(2)加入0.1g mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示.解释反应速率变化的原因