摘要:方法上重点.难点:如何寻找.选择解决问题的途径.建立数学模型. [课前准备]学生课前探讨.完成下列表格: 假定我们有一篓面值一元的硬币.假定每一硬币的形状.体积.质量是相同的.我们通过哪些方法或途径可以知道这篓硬币的个数? 序 号 方 法 或 途 径 方法一 方法二 -- [教学过程] 第 一 课 时 [交流.研讨]在开始今天的化学课之前.请同学们先回答我们布置的课前智力游戏: 假定我们有一篓面值一元的硬币.假定每一硬币的形状.体积.质量是相同的.我们通过哪些方法或途径可以知道这篓硬币的个数? 序 号 方 法 或 途 径 方法一 方法二 方法三 方法四 方法五 方法六 方法七 方法八 -- 直接数数 先称量出一个硬币的质量.再用硬币的总质量除以一个硬币的质量 先称量出100个硬币的质量.用硬币的总质量除以100个硬币的质量.再乘以100 先称量出一个硬币的体积.再用硬币的总体积除以一个硬币的体积 先称量出100个硬币的体积.用硬币的总体积除以100个硬币的体积.再乘以100 先测量出一个硬币的厚度.再将硬币垒起来.用硬币的总厚度除以一个硬币的厚度 先测量出100个硬币的厚度.再将硬币垒起来.用硬币的总厚度除以100个硬币的厚度.然后乘以100 用模具(比如一木板上刻有许多凹槽.每一凹槽中正好卡入10个硬币)计量 -- [建立模型] 我把上述方法总结为两种方法模型:直接计量和换算.前者直接获得硬币个数.后者通过引入中间物理量搭桥.换算出硬币个数. [讲述.媒体显示] 模型一:直接计量 模型二:引入中间物理量换算 [引言] 下面我们来研究一个化学上经常遇到的宏观物质的质量.体积与构成它的微观粒子数之间的关系问题.也就是第三节所讲述的内容. [讲述.媒体显示]第三节 化学中常用的物理量――物质的量
网址:http://m.1010jiajiao.com/timu_id_4434900[举报]
(2013?淄博一模)氢溴酸在医药和石化工业上有广泛用途.如图是模拟工业制备氢溴酸的流程如图1:

回答下列问题:
(1)混合①中发生反应的离子方程式为
(2)混合②中加入试剂a是
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+②含Br2③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因.该试剂是
a.KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.淀粉KI溶液 e.CCl4
(5)实验室制取Br2的反应为:2NaBr+3H2SO4+NmO2
2NaHSO4+MnSO4+Br2↑+2H2O 制取Br2最好选用下列装置中的
查看习题详情和答案>>

回答下列问题:
(1)混合①中发生反应的离子方程式为
SO2+Br2+2H2O=4H++2Br-+SO42-
SO2+Br2+2H2O=4H++2Br-+SO42-
.(2)混合②中加入试剂a是
BaCl2溶液
BaCl2溶液
.(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是
SO32-+2H+=SO2↑+H2O
SO32-+2H+=SO2↑+H2O
(请用离子方程式表示).(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+②含Br2③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因.该试剂是
e
e
(填写字母).a.KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.淀粉KI溶液 e.CCl4
(5)实验室制取Br2的反应为:2NaBr+3H2SO4+NmO2
| ||
c
c
(填写字母,固定和加热装置均已省略).简述检验图2装置气密性的方法关闭分液漏斗活塞,将烧瓶上的导气管连接一段橡皮管并伸入水中,用手捂热烧瓶,若导管末端有气泡产生,冷却后导管中上升一段水柱,证明装置气密性良好
关闭分液漏斗活塞,将烧瓶上的导气管连接一段橡皮管并伸入水中,用手捂热烧瓶,若导管末端有气泡产生,冷却后导管中上升一段水柱,证明装置气密性良好
.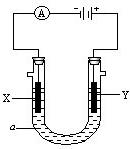 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解 液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解 液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式是
②Y电极上的电极反应式是
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是
②Y电极的材料是
③假若电路中有0.04摩尔电子通过时,阴极增重
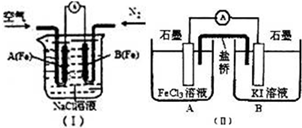 研究铁及铁的化合物的性质具有重要意义.
研究铁及铁的化合物的性质具有重要意义.(1)如图(I)是为研究钢铁腐蚀部位与水中O2浓度的关系而设计的装置,该装置化学上称为差异充气电池.实验中观察到电流计指针偏转,B(Fe)极被腐蚀,则A(Fe)极的电极反应式为
(2)常温下,铁可在某些强氧化剂溶液中形成钝化膜而被保护.为探究钝化膜的成分,取一小段钝化后的铁片放入稀硫酸中加热,使铁片完全溶解.取1mL溶解液滴入3~5滴KmnO4溶液,观察到溶液紫色逐渐退去,则该反应的离子方程式是
(3)FeC13溶液与KI溶液混合,离子方程式为
[方法1]取2mL0.1mol?L-1
[方法2]设计原电池装置如图(II),测得电流计指针偏转方向是电子的流动方向.开始观察到电流计指针向
 Ⅰ山西河东地区是中华文明的发祥地之一,那里有一个被称为“中国死海”的湖泊--运城盐池.
Ⅰ山西河东地区是中华文明的发祥地之一,那里有一个被称为“中国死海”的湖泊--运城盐池.(1)该湖水含盐量极高,但其中不可能大量存在的是
C
C
A、NaClB、NNO3C、CaCO3D、Na2SO4
(2)一年四季,盐湖变换着不同的景色.春、秋两季碧波万顷,湖水清澈;夏季气温高达42℃,水位下降,生长的藻类使湖水变成了红色;冬季湖面上盐花丛生,洁白如雪.上述景色变换中包含的过程有
①③⑤
①③⑤
(填序号).①蒸发; ②蒸馏; ③结晶; ④升华; ⑤溶解
Ⅱ阅读、分析下列两个材料:
材料一:读图
材料二:
| 物质 | 熔点/℃ | 沸点/℃ | 密度g?cm-3 | 溶解性 |
| 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水 和乙醇 |
| 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒 精以任意比 互溶 |
A、蒸馏法 B、萃取法 C、“溶解、结晶、过滤”的方法 D、分液法
(1)将纯碱从氯化纳和纯碱的混合物中分离出来,最好应用
C
C
.(2)将乙二醇和丙三醇相互分离的最佳方法是
A
A
.(3)用CCl4提取溴水中的溴单质的最佳方法是
B
B
.(4)分离汽油和水的最佳方法是
D
D
.2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展,人口增多,对能源的需求量逐年增加,全球石油储量下降.寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法.
已知:
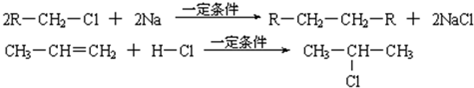
(1)凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:

(2)
(3)合成路线如下:
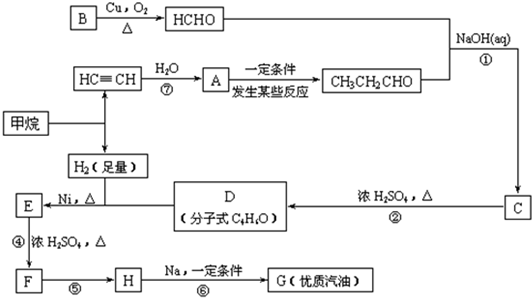
(1)写出D的结构简式
(2)在反应②~⑦中,属于加成反应的是
(3)写出下列反应方程式
E→F:
H→G:
(4)H也能与NaOH水溶液反应,其反应方程式为
 ,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化
,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化
查看习题详情和答案>>
已知:
(1)凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:

(2)

(3)合成路线如下:

(1)写出D的结构简式
CH2=CH(CH3)CHO
CH2=CH(CH3)CHO
(2)在反应②~⑦中,属于加成反应的是
③⑤⑦
③⑤⑦
,属于消去反应的是②④
②④
.(3)写出下列反应方程式
E→F:
CH3CH(CH3)CH2OH
CH3CH=(CH3)CH2+H2O
| 浓硫酸 |
| △ |
CH3CH(CH3)CH2OH
CH3CH=(CH3)CH2+H2O
;| 浓硫酸 |
| △ |
H→G:
2(CH3)3CCl+2Na
(CH3)3CC(CH3)3+2NaCl
| 一定条件 |
2(CH3)3CCl+2Na
(CH3)3CC(CH3)3+2NaCl
.| 一定条件 |
(4)H也能与NaOH水溶液反应,其反应方程式为


否
否
(选填“能”或“否”).