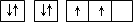网址:http://m.1010jiajiao.com/timu_id_437330[举报]
一、(每题2分,共10分)w.w.w.k.s.5.u.c.o.m
1.D 2.B 3.C 4.D 5.A
二、(每题3分,共36分)
6.B 7.B 8.A 9.C 10.A 11.D 12.C 13.D 14.C 15.D 16.B 17.A
三、(每题4分,共20分)
18.B、D 19.B、C 20.A、C 21.A、D 22.B、C
四、(本题共24分)
23.(本题8分,每格1分)(1)1s22s22p3 第2周期ⅣA族
(2)
(3)两性
H++AlO2?+H2O.files/image034.gif) Al(OH)3
Al(OH)3.files/image034.gif) Al3++3OH?
Al3++3OH?
(4)非极性 CH4(g)+2O2(g) → CO2(g) +2H2O(l) +890.3kJ
24.(本题8分)
(1) 24e
.files/image035.gif) ↓ │
(配平2分,电子转移方向和数目各1分,共4分)
↓ │
(配平2分,电子转移方向和数目各1分,共4分)
12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl
(2)NH3(1分),NH4Cl 和HCl(各1分,共2分) (3)0.08(1分)
25.(本题8分,除指明外,每格1分)(1)0.05 mol/(L•min) (无单位不得分) >
(2)1 扩大容器体积(或减小压强) (3)= (4)放热 (2分) (5)20~40
五、(本题共24分)
26.(本题10分,除指明外,每格1分)
(1)CN-+ClO-→CNO-+Cl? ,2CNO-+6ClO?+8H+→N2↑+2CO2↑+3Cl2↑+4H2O
(2)浓硫酸, 除去Cl2 , 吸收CO2 , 防止空气中的CO2、水蒸气进入,干扰实验
(3)偏低,装置中残留有CO2未被完全吸收 (4)80%(2分)
27.(本题14分,除指明外,每格1分)
(1)反应速率突然减小(或铁片表面生成的气泡突然减少) e .files/image037.gif)
(2)洗涤、烘干(或干燥) 过滤
(3)b、d(各1分,共2分),加快铁片与硫酸的反应速率,Fe和Cu(1分,有缺不得分)
(4)抑制Fe2+、NH4+水解 (5)避免加热过程中晶体受热分解(或被氧化)
(6)b、d(各1分,共2分)
.files/image039.gif) 六、(本题共20分)
六、(本题共20分).files/image023.gif) w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(本题8分,除指明外,每格1分)(1)取代反应,加聚反应 (2) CH2== CH2
.files/image041.gif) (3)CH2== CH―CH2Cl + Br2 →
(3)CH2== CH―CH2Cl + Br2 →.files/image043.gif) (2分) (4)5 、
(2分) (4)5 、
29.(本题12分)(1)1,2―二溴乙烷(1分), .files/image045.gif) (1分)
(1分)
(2)取代反应(1分),NaOH醇溶液、加热(1分)
.files/image046.gif) (3)n
(3)n.files/image048.gif)
.files/image050.gif) (2分)
(2分)
.files/image051.gif) (4)
(4).files/image053.gif) +
+ .files/image045.gif)
.files/image055.gif) +
H2O(2分)
+
H2O(2分)
(5).files/image057.gif) (2分) (6)5(2分)
(2分) (6)5(2分)
七、(本题共16分).files/image023.gif) w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30. (1)1:3 (2分) (2)3.2(2分) (3)6048 (2分)
解:(1)Fe+2HCl→FeCl2+H2↑ n(H2)=.files/image059.gif) =0.005(mol) ∴ n(Fe)=0.005(mol)
=0.005(mol) ∴ n(Fe)=0.005(mol)
m(Fe) =0.005×56=0.28(g) ∴ m(FeS)=1.6?0.28=1.32(g) n(FeS) =.files/image061.gif) =0.015(mol)
=0.015(mol)
∴ n(Fe):n(FeS) = 0.005:0.015= 1:3
(2)300mL溶液种最多溶解H2S:n(H2S) =0.1×0.3=0.03(mol)
∴ n(FeS)= n(H2S)=0.03(mol) n(Fe)=0.01(mol)
∴ m(Fe)+m(FeS)= 0.01×56+0.03×88=3.2(g)
(3)当a=
若全部反应需盐酸:2×(0.3+0.1) =0.8 (mol) > 2×0.3=0.6(mol)
∴ 盐酸不足,以盐酸的量为计算标准
∴ 产生的H2、H2S共为:n(气体)=.files/image063.gif) n(HCl) =
n(HCl) =.files/image063.gif) ×0.6=0.3(mol),
×0.6=0.3(mol),
其中0.03mol的H2S溶解于溶液
∴ 收集到的气体为:0.3?0.03=0.27 (mol)
V(气体)=0.27×22.4=6.048(L)=6048mL
31.(1)c、d (2分) (2)①2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2(1分)
②.files/image065.gif) ≥
≥.files/image067.gif) (或
(或.files/image069.gif) (2分)③1:5 (3分)
(2分)③1:5 (3分)
解:(2)②将20%的N2O4看作成2份NO2,即NO2共有
若气体恰好被吸收则:.files/image065.gif) ≥
≥.files/image067.gif)
生成的产物NaNO2、NaNO3中钠原子与氮原子均为1:1,所以由原子守恒得:
n(Na2CO3)=.files/image063.gif) n(Na)=
n(Na)=.files/image063.gif) n(N)=
n(N)=.files/image063.gif) [n(NO2)+n(NO)]=
[n(NO2)+n(NO)]=.files/image063.gif) ×
×.files/image071.gif) =
=.files/image073.gif) (mol)
(mol)
∴ c(Na2CO3)= .files/image073.gif) ÷0.2=
÷0.2=.files/image076.gif) (mol/L)
(mol/L)
③设:
.files/image077.gif) x+y+z=
x+y+z=.files/image079.gif) =0.09
解得: x=0.01(mol)
=0.09
解得: x=0.01(mol)
2x+y+3z=.files/image081.gif) ×4 (得失电子守恒)
y=0.05(mol)
×4 (得失电子守恒)
y=0.05(mol)
.files/image077.gif) 2x+y+z=0.05×2 (氮原子、钠原子守恒) z=0.03(mol)
2x+y+z=0.05×2 (氮原子、钠原子守恒) z=0.03(mol)
∴ V(N2O4):V(NO2) = n(N2O4):n(NO2) =x:y= 1:5
A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
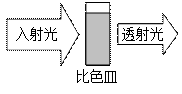
 将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有 。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是 。测定标准溶液按浓度 (填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理
 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
⑸原果汁样品中Vc的浓度为 mg/L
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法 。
查看习题详情和答案>>(一)新制氢氧化铜悬浊液的配制与应用:
(1)实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的________溶液2mL,滴入2%的
_________溶液4~6滴(以上选填“硫酸铜”或“氢氧化钠”),振荡即成。这样操作的目的_______________________________________________。
(2)下列各组物质的溶液仅用新制的氢氧化铜悬浊液(必要时可以加热)不能检验出来的是______。 A.HCOOCH3,C6H5COOH,C6H5CH2OH
B.NaHSO4,BaCl2,Na2CO3,酚酞
C.HCOOH,HCOONa,HCOOCH2CH3
D.葡萄糖,CH2OHCHOHCH2OH
(二)下列是四个研究性学习小组分别从不同层面开展研究性学习活动:
(3)研究性学习小组甲为了探究新制氢氧化铜与久置氢氧化铜氧化性的差异性,利用乙醛作还原剂,他们设计的方案是:取编号为X、Y的两支试管,分别装入一定量的新制氢氧化铜悬浊液和氢氧化铜沉淀,再分别加入3mL乙醛溶液,同时用水浴加热几分钟,结果X试管里出现砖红色沉淀,而Y试管出现黑色。你认为可能的原因是_____________________________________________________________。
(4)研究性学习小组乙对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是Cu2O。为了确定红色沉淀的成分,开展了如下研究:
提出猜想:__________________________________________。
查阅资料:①Cu2O属于碱性氧化物;
②+1价的铜离子在酸性条件下易发生自身氧化还原反应;
③在空气中灼烧Cu2O会生成CuO。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为b g,比较a,b关系。
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为合理的方案是_____________。
(5)研究性学习小组丙,设计新方案,装置如图所示。你认为要测定红色沉淀成分必须测定下列哪些物理量:____________________________。

(6)研究性学习小组丁上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。“变废为宝”符合绿色化学要求,因此他们想收集上述红色沉淀以制备化学试剂--蓝矾。
请你帮助他们设计一个实验方案:_________________________________________________________
A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有 。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是 。测定标准溶液按浓度 (填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理
 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法 。
[化学——选修物质结构与性质](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为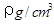 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为 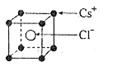
A.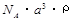 g/mol B.
g/mol B.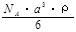 g/mol
g/mol
C.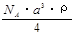 g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.(12分)现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
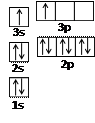
| A | 原子的电子排布图为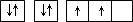 |
| B | 常温下单质为双原子分子,原子间形成三对共用电子对 |
| C | 原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D | 二价阳离子与C的阴离子具有相同的电子层结构 |
| E | 原子序数是D两倍, |
(1)A、B、C的第一电离能由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ;
(3)E在周期表中的位置是 ,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为 ;
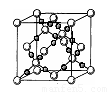
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为 ;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
 查看习题详情和答案>>
查看习题详情和答案>>
[化学——选修物质结构与性质](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1) 下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为

A.  g/mol B.
g/mol B. g/mol
g/mol
C.  g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.(12分)现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
原子的电子排布图为 |
|
B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
|
C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
|
D |
二价阳离子与C的阴离子具有相同的电子层结构 |
|
E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ;
(3)E在周期表中的位置是 ,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为 ;
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为 ;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
查看习题详情和答案>>