网址:http://m.1010jiajiao.com/timu_id_428197[举报]
Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:______.
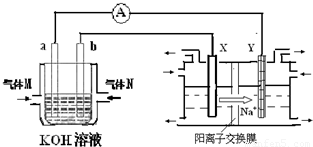
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是______(填“正极”或“负极”),气体M的分子式______,a电极上发生的电极反应式为:______.
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为______mol.(保留小数点后2位)
Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ?mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是______.
①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
| 物质的量/(mol)/时间(h) | 1 | 2 | 3 | 4 | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为______kJ.
②0~1小时内N2的平均反应速率______mol?L-1?h-1.
③此条件下该反应的化学平衡常数K═______(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向______方向移动(填“正反应”或“逆反应”或“不移动”.)
 查看习题详情和答案>>
查看习题详情和答案>>
(08年浙江省温州市十二校月考)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4?5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤①、③中研磨固体所用仪器的名称是__________________;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
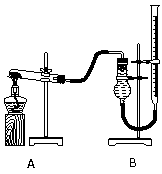 用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
用右图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
④ | 1.2 g | 无其他物质 |
|
⑤ | 1.2 g | CuO 0.5 g |
|
⑥ | 1.2 g | MnO2 0.5 g |
|
回答下列问题:
⑵上述实验中的“待测数据”指_______ _____;
⑶本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
⑷若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞, ;
⑸为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._________________________ __ ____,b.CuO的化学性质有没有改变。
查看习题详情和答案>>
铝及铝合金经过阳极氧化,铝表面能生成几十微米的较厚的氧化铝膜。

Ⅰ.某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面;
b.用水冲洗经有机物擦洗的铝片,浸入60~70 ℃的2 mol·L-1的NaOH溶液中,以除去原有的氧化膜,约1 min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解;
c.阳极氧化,以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。
试回答下列问题:
(1)用苯和酒精擦拭铝片的目的:_______________________________,
氢氧化钠溶液处理铝片时反应的离子方程式是____________________________________。
(2)阳极的电极反应式为______________________________。
(3)下列有关说法正确的是________(填字母代号)。
A.电解时电子从电源负极→导线→铅极,铝极→导线→电源正极
B.在电解过程中,H+向阳极移动,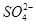 向阴极移动
向阴极移动
C.电解过程中溶液的pH基本不变
D.电解时,铝片为阳极,被氧化
Ⅱ.另一小组针对铝表面保护膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期用来盛放和腌制咸菜。究其原因,该小组设计了一个实验以探究其中的原因。他们的实验过程如下:
|
实验 |
|
|
|
编号 |
实验过程 |
实验现象 |
|
1 |
取一小片铝片于试管中,加入1.0 mol·L-1的盐酸2 mL |
30秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
2 |
取一小片铝片于试管中,加入0.5 mol·L-1的硫酸2 mL |
55秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
3 |
取一小片铝片于试管中,加入氯化铜稀溶液 |
3分钟左右表面产生少量气泡,且铝表面析出一些红色固体 |
|
4 |
取一小片铝片于试管中,加入硫酸铜稀溶液 |
一直没有明显的变化 |
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是________________________________________________________________________。
根据该实验现象,你认为铝制容器不能长期盛放和腌制咸菜的原因是________________________________________________________________________。
查看习题详情和答案>>
铝及铝合金经过阳极氧化,铝表面能生成几十微米的较厚的氧化铝膜.
Ⅰ.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
b.用水冲洗经有机物擦洗的铝片,浸入60~70℃的2 mol/L的NaOH溶液中,以除去原有的氧化膜,约1 min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解.
c.阳极氧化.以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40 min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20~30 min,即可得到更加致密的氧化膜.
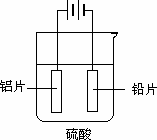
试回答下列问题
(1)用苯和酒精擦拭铝片的目的:________,氢氧化钠溶液处理铝片时反应的离子方程式是________.
(2)阳极的电极反应式为:________.
(3)下列有关说法正确的是________(填序号).
A.电解时电子从电源负极→导线→铅极,铝极→导线→电源正极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中溶液的pH基本不变
D.电解时,铝片为阳极,被氧化
Ⅱ.另一小组针对铝表面保护膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期用来盛放和腌制咸菜.究其原因,该小组设计了一个实验以探究其中的原因.他们的实验过程如下:
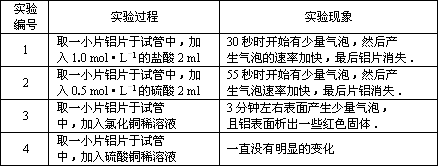
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是________根据该实验现象,你认为铝制容器不能长期盛放和腌制咸菜的原因是________.
“关注民生”和“科学发展”是“十七大”报告的主题之一,环境问题与“民生”和“科学发展”密切相关。世界环保组织2006年度报告指出,在所有衡量地球健康状况的指标中,人类仅成功地扭转了一项指标的恶化-大气中氯氟烃减少,而C、S、N氧化物的排放有增无减,水资源的紧缺和污染加剧。保证经济走可持续发展的道路,是化学工作者应尽的职责所在。回答下列问题:
(1)大气中氯氟烃的减少带来的积极效果是 ;
(2) 酸雨的化学特征是 。空气中硫氧化物和氮氧化物是形成酸雨的主要物质。若用NOx表示氮氧化物,请写出空气中氮氧化物形成酸雨的化学方程式
;
(3) SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:

① 在实验室测定模拟烟气中SO2的体积分数,现有注射器、洗气瓶、导管、量筒等仪器,需要的药品有 ;
② 若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,已知气体流速,还需测定的数据是 ;
(4)水体富营养化是导致水体藻类大量繁殖的主要因素。2007年春夏之交我省无锡太湖蓝藻事件再次给水资源保护敲响警钟。检测显示,蓝藻爆发时太湖全湖N、P平均含量分别高达4.0和0.13 mg/L。环境专家建议用金属镁将水体中的NO3-还原为N2而消除污染,Mg则转变为Mg(OH)2沉降湖底。要使太湖水中N的平均含量下降至0.20 mg/L,则每立方米水体中应投入的镁粉应不少于 g。
查看习题详情和答案>>