摘要:(三)氧族元素
网址:http://m.1010jiajiao.com/timu_id_428001[举报]
元素周期律和元素周期表对深化物质性质的认识具有重要的作用,有利于将零乱的元素化合物知识整合起来形成知识网络.某同学整理了关于氯元素的相关知识,请你补充完整.
(1)氯元素的原子结构示意图为
 ,在周期表中的位置为
,在周期表中的位置为
(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为
(3)含有氯元素的常见物质转化关系如图: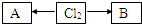 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
查看习题详情和答案>>
(1)氯元素的原子结构示意图为


第三周期、第ⅦA族
第三周期、第ⅦA族
.(2)氯、硫、磷三种元素对应的气态氢化物中,稳定性由强到弱的顺序为
HCl>H2S>PH3
HCl>H2S>PH3
,氯、溴两种元素的单质中,氧化性强的是Cl2
Cl2
,设计简单的实验方案证明取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2
取少量NaBr(HBr)溶液,向其中通入氯气,溶液变为橙色,则证明Cl2的氧化性强于Br2
.(3)含有氯元素的常见物质转化关系如图:
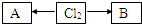 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
| ||
4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是
| ||
HClO4
HClO4
(填化学式).元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素中最不活泼的是
(2)①、④两种元素的最高价氧化物对应的水化物相互反应的化学方程式是
(3)⑥元素的氢化物是
(4)高温下灼烧含元素①的化合物时,火焰呈
(5)①、②、③三种元素金属性活动顺序由强到弱为
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(1)这九种元素中最不活泼的是
Ar
Ar
(填元素符号),最高价氧化物对应水化物碱性最强的是KOH
KOH
(填化学式,下同),最高价氧化物对应水化物酸性最强的是HClO4
HClO4
(填化学式,下同),最高价氧化物对应水化物成两性的是Al(OH)3
Al(OH)3
(填化学式,下同),(2)①、④两种元素的最高价氧化物对应的水化物相互反应的化学方程式是
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+NaOH=NaAlO2+2H2O
.(3)⑥元素的氢化物是
H2O
H2O
(填化学式),该氢化物在常温下与②发生反应的化学方程式为2K+H2O=2KOH+H2↑
2K+H2O=2KOH+H2↑
,离子方程式为2K+H2O=2K++2OH-+H2↑
2K+H2O=2K++2OH-+H2↑
,所得溶液的pH>
>
(填“<”、“>”或“=”)7.(4)高温下灼烧含元素①的化合物时,火焰呈
黄
黄
色.(5)①、②、③三种元素金属性活动顺序由强到弱为
K>Na>Mg
K>Na>Mg
,判断的依据是与水反应的剧烈程度K>Na>Mg
与水反应的剧烈程度K>Na>Mg
(写出一条就可以).元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)这九种元素中化学性质最不活泼的是
(2)在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是
(3)元素 ④与⑦的最高价氧化物对应水化物反应离子方程式为
(4)⑥元素的氢化物是
(5)⑦元素与①元素形成的化合物的电子式为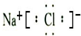
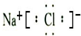 .
.
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | 2 | ⑤ | ⑥ | 3 | ① | ③ | ④ | ⑦ | ⑨ | 4 | ② | ⑧ |
(1)这九种元素中化学性质最不活泼的是
⑨
⑨
.(填元素符号,下同)(2)在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是
KOH
KOH
(填化学式).(3)元素 ④与⑦的最高价氧化物对应水化物反应离子方程式为
Al(OH)3+3H+=2Al3++3H2O
Al(OH)3+3H+=2Al3++3H2O
.(4)⑥元素的氢化物是
H2O
H2O
(填化学式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
.(5)⑦元素与①元素形成的化合物的电子式为
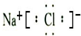
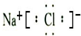
元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)B元素在元素周期表中的位置
第三周期第ⅢA族
第三周期第ⅢA族
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(填化学式).(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
离子键和非极性键
离子键和非极性键
.(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
Cl<S<Al<Mg
Cl<S<Al<Mg
.