网址:http://m.1010jiajiao.com/timu_id_427929[举报]
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为第
根据元素周期律,预测:酸性强弱 H3AsO4
(2)元素S的最高正价和最低负价的代数和为
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
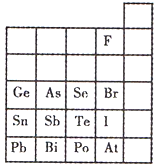 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.(1)根据元素周期律预测:酸性强弱H3AsO4
(2)元素Se的最高正价和最低负价的代数和为
(3)I2具有一定的氧化性,SO2具有较强的还原性,将适量SO2气体通入碘水后,溶液中主要存在的离子是
(4)下列说法不正确的是
a.C、N、O、F的原子半径随着原子序数的增大而减小
b.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
c.干冰升华、水蒸气的液化都要吸热
d.HF、HCl、HBr、HI的热稳定性依次减弱.
(7分)
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。
(1)阴影部分元素N在元素周期表中的位置为 周期 族 。 根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为____________; 在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”);
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是_____________。
(4)下列说法不正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看习题详情和答案>>
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
(1)阴影部分元素在元素周期表中的位置为第 族。根据元素周期律、预测;酸性强弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看习题详情和答案>>
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。
(1)阴影部分元素在元素周期表中的位置为第 族。根据元素周期律、预测;酸性强弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为 ,在一定 条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
(4)下列说法正确的是
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱