网址:http://m.1010jiajiao.com/timu_id_420911[举报]
一、单项选择题
1.D 2.C 3.B 4.C 5.D 6.C 7.A 8.B
二、不定项选择题
9.D 10.BC 11.D 12.AC 13.CD 14.A
三、非选择题(本题包括6小题,共60分)
15.(12分)
(1)500mL容量瓶 (1分)、玻璃棒(1分) 淀粉溶液 (1分)
(2)碱式(2分) 滴入最后一滴硫代硫酸钠溶液,溶液蓝色褪去,且半分钟内不恢复。(2分)(3)为保证I-全部转化为I2,所加氧化剂应稍过量。如果选用新制氯水或KMnO4作氧化剂,则过量的这些氧化剂在滴定时会氧化硫代硫酸钠而导致测定结果偏大。(2分)
(4)0.06410% (3分)
16.(8分)
----化学.files/image034.gif) (1)
(1分) CO(NH2)2 (1分)
(1)
(1分) CO(NH2)2 (1分)
(2) N2+Al2O3+----化学.files/image035.gif)
----化学.files/image036.gif) 3CO+2AlN (2分)
3CO+2AlN (2分)
(3) AlN+OH-+H2O =AlO----化学.files/image038.gif) +NH3↑ (2分)
+NH3↑ (2分)
(4) ④⑦ (2分)
17.(8分)
(1)温度较低(2分)
(2)AC(2分)
(3)2Fe3+ + 3ClO- + 10 OH- = 2FeO4-+ 3Cl-+ 5H2O (2分)
(4)B、D(2分)
18.(10分)
(1)CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g)
△H=一867 kJ?mol一1 (2分)
(2) Na2S+2H2O----化学.files/image040.gif) S↓+H2↑+2NaOH (2分) 或S2-+2H2O
S↓+H2↑+2NaOH (2分) 或S2-+2H2O----化学.files/image040.gif) S↓+H2↑+2OH-
S↓+H2↑+2OH-
(3)Ksp(HgS)<Ksp(FeS) (2分) 因发生Hg2++FeS=HgS+Fe2+,产生的Fe2+可被氧化为Fe3+,Fe3+水解形成Fe(OH)3胶体,吸附悬浮杂质而净化水(2分)
(4)尿素法成本低,节约能源。(2分)
----化学.files/image041.gif) 19.(12分)
19.(12分)
(1) (2分)
(2) 3种 (2分)
(3) 6 (2分)
(4)A: ----化学.files/image043.jpg) (2分)
② 过氧化物、HBr(1分)
(2分)
② 过氧化物、HBr(1分)
----化学.files/image045.jpg) |
B: (2分) ④ 浓硫酸(1分)
20.(10分)
(1)不能 (1分) BaCO3会与胃酸反应产生Ba2+使人中毒 (2分) 或说由于存在溶解平衡:BaCO3(s) ----化学.files/image047.gif) Ba2+(aq)+CO32-(aq),服下BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向右移动,Ba2+浓度增大引起人体中毒。
Ba2+(aq)+CO32-(aq),服下BaCO3后,胃酸可与CO32-反应生成CO2和水,CO32-浓度降低,BaCO3的沉淀溶解平衡向右移动,Ba2+浓度增大引起人体中毒。
(2)BaSO4(s)----化学.files/image048.gif) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
C(Ba2+)=1.1×10-10/0.36 =3.1×10-10 < 2×10-3mol?L-1
可以有效除去Ba2+ (3分)
(3)Ba2+ ~ BaCrO4 ~----化学.files/image050.gif) Cr2O72-~
Cr2O72-~----化学.files/image052.gif) I2~ 3S2O32-
I2~ 3S2O32-
1mol 3mol
36.00×0.100×10-3mol
c(Ba2+)----化学.files/image054.gif) mol?L-1
(4分)
mol?L-1
(4分)
四、选做题(本题包括1小题,共12分)
21.(12分)
(1)1s22s22p63s23p63d104s24p1 (2分)
(2)ACD (2分)
(3)非极性分子(2分) 三角锥 (2分) sp2 (2分)
(4)NH3分子间能形成氢键,而AsH3分子间不能形成氢键 (2分)
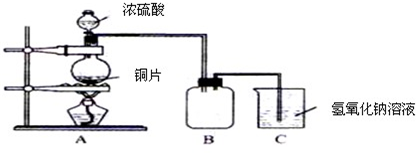
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
| ||
| ||
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是 ;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是: (填写编号).
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度.假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“不能”),其理由是 .
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首.汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 1 | 2 | 3 | 4 | 5 | |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
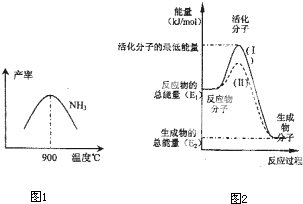
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
| 1 |
| 2 |
(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
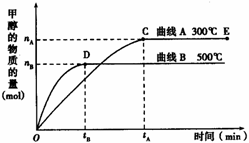 如右图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g)
如右图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
A.H2的转化率一定增大 B.v正一定增大,v逆一定减小
C.CH3OH的质量分数一定增加 D.v逆一定小于v正
查看习题详情和答案>>(9分) 如图所示,一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) +2H2(g) ![]() CH3OH(g)
CH3OH(g)
上述可逆反应正反应为___________反应(填“放热”或“吸热”)。
在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) =___________________________(用nB、tB表示)。
对处于E点的体系,改变外界条件使平衡向正反应方向移动时,下列有关该体系的说法正确的是______________________(填字母)。
A.H2的转化率一定增大 B.v正一定增大,v逆一定减小
C.CH3OH的质量分数一定增加 D.v逆一定小于v正
查看习题详情和答案>>