网址:http://m.1010jiajiao.com/timu_id_400263[举报]
(2008·全国Ⅰ理综)电解100 mL含c(H+)=0.30 mol/L的下列溶液。当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
A.0.10 mol/L Ag+ B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+ D.0.20 mol/L Pb2+
查看习题详情和答案>>
(2008年北京卷,理综,27)(3)用图示装置制备NO并验证其还原性。有下列主要操作:
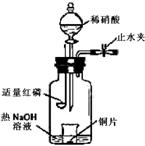 a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
查看习题详情和答案>>(08年山东理综·29)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC![]() CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH![]() CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC![]() CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH![]() CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
查看习题详情和答案>>(07年理综北京卷?8)X、Y为短周期元素,X位于I A族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
查看习题详情和答案>>(2008·全国Ⅰ理综)电解100 mL含c(H+)=0.30 mol/L的下列溶液。当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )
| A.0.10 mol/L Ag+ | B.0.20 mol/L Zn2+ |
| C.0.20 mol/L Cu2+ | D.0.20 mol/L Pb2+ |