摘要:掌握糖类的结构.性质.用途,
网址:http://m.1010jiajiao.com/timu_id_400201[举报]
某化学学习兴趣小组,为了研究晶体的结构和性质,查阅了一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)?H2O相关资料:
一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)?H2O为蓝色正交晶体,常温下,它易溶于水,受热分解产生氨气和硫酸铜,易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末.
它的制备原理是利用硫酸铜溶液和氨水反应生成,其晶体的析出一般不宜用蒸发浓缩等常规方法.析出晶体方法:向硫酸铜溶液中加入浓氨水后,再加入浓乙醇溶液使晶体析出.
请回答下列问题:
(1)请写出制备硫酸四氨合铜(Ⅱ)的反应方程式:
(2)析出晶体不用蒸发浓缩方法的原因是
(3)硫酸四氨合铜属于配合物,晶体中Cu2+与NH3之间的键型为
(4)请你设计实验方案探究确定SO2-4为配合物外界.
查看习题详情和答案>>
一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)?H2O为蓝色正交晶体,常温下,它易溶于水,受热分解产生氨气和硫酸铜,易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末.
它的制备原理是利用硫酸铜溶液和氨水反应生成,其晶体的析出一般不宜用蒸发浓缩等常规方法.析出晶体方法:向硫酸铜溶液中加入浓氨水后,再加入浓乙醇溶液使晶体析出.
请回答下列问题:
(1)请写出制备硫酸四氨合铜(Ⅱ)的反应方程式:
CuSO4+4NH3+H2O=[Cu(NH3)4]SO4?H2O
CuSO4+4NH3+H2O=[Cu(NH3)4]SO4?H2O
.(2)析出晶体不用蒸发浓缩方法的原因是
[Cu(NH3)4]SO4?H2O受热分解
[Cu(NH3)4]SO4?H2O受热分解
;其中乙醇的作用是硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度或减小水的极性
硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度或减小水的极性
.(3)硫酸四氨合铜属于配合物,晶体中Cu2+与NH3之间的键型为
配位键
配位键
,该化学键能够形成的原因是NH3能提供孤对电子,Cu2+能接受孤对电子(或有空轨道)
NH3能提供孤对电子,Cu2+能接受孤对电子(或有空轨道)
.(4)请你设计实验方案探究确定SO2-4为配合物外界.
取硫酸四氨合铜晶体溶于水配成溶液,向溶液中加入适量的Ba(NO3)2溶液,溶液中出现白色沉淀,说明溶液中有SO42-存在于外界
取硫酸四氨合铜晶体溶于水配成溶液,向溶液中加入适量的Ba(NO3)2溶液,溶液中出现白色沉淀,说明溶液中有SO42-存在于外界
.A、B、X、Y、Z为短周期元素,它们的原子序数依次增大;A是自然界中组成化合物种类最多的元素之一:B元素的最高价氧化物对应的水化物与其简单氢化物反应生成一种盐G;元素A与Y同主族,且Y元素在短周期元素中的原子半径最大(不考虑稀有气体);Z元素的核电荷数是X的2倍.请回答下列问题:
(1)盐G的晶体内所含化学键类型是 ;在常温下测得该盐的某浓度溶液pH=6,则盐中的阴、阳离子在该溶液中的浓度之差的数值等于 (精确计算);
(2)将元素A与Z形成的化合物与过量NaOH反应生成物质F,F的水溶液在空气中长期放置发生反应,生成M和N两种物质,M与过氧化钠的结构和性质相似,则N的电子式为 ;
(3)有两种化合物同时含有上述元素中的四种相同元素,这两种化合物的水溶液混合后迅速反应,生成物中仍有一种含上述四种元素,写出该产物的化学式: ,该反应的离子方程式是 ;
(4)将由BX和BX2组成的混合气体通入下图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2).
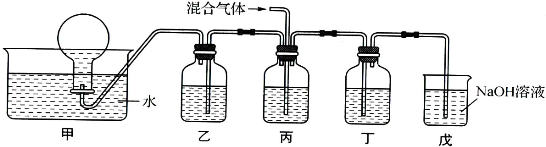
已知:①浓硝酸能将BX氧化成BX2,而稀硝酸不能氧化BX;
②NaOH溶液与BX2能发生反应生成两种盐和水,NaOH溶液与BX不反应.
a.装置乙、丙、丁中盛放的药品依次是 、 、 ;
b.能够说明实验已成功的现象是 .
查看习题详情和答案>>
(1)盐G的晶体内所含化学键类型是
(2)将元素A与Z形成的化合物与过量NaOH反应生成物质F,F的水溶液在空气中长期放置发生反应,生成M和N两种物质,M与过氧化钠的结构和性质相似,则N的电子式为
(3)有两种化合物同时含有上述元素中的四种相同元素,这两种化合物的水溶液混合后迅速反应,生成物中仍有一种含上述四种元素,写出该产物的化学式:
(4)将由BX和BX2组成的混合气体通入下图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2).

已知:①浓硝酸能将BX氧化成BX2,而稀硝酸不能氧化BX;
②NaOH溶液与BX2能发生反应生成两种盐和水,NaOH溶液与BX不反应.
a.装置乙、丙、丁中盛放的药品依次是
b.能够说明实验已成功的现象是
原子形成化合物时,电子云间的相互作用对物质的结构与性质会产生影响.试回答:
(1)BF3分子的立体结构为
(2)碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同.在乙烷、乙烯、乙炔分子中,碳原子进行sp3杂化的分子是(写结构简式)
(3)H2O、NH3、CH4分子中键角由大到小的顺序为
(4)由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡.阳离子电荷数越大、阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小.据此,四种卤化银在水中的溶解度由大到小的顺序为
查看习题详情和答案>>
(1)BF3分子的立体结构为
平面三角
平面三角
形,NF3分子的立体结构为三角锥
三角锥
形.(2)碳原子有4个价电子,在有机化合物中价电子均参与成键,但杂化方式不一定相同.在乙烷、乙烯、乙炔分子中,碳原子进行sp3杂化的分子是(写结构简式)
CH3CH3
CH3CH3
,存在一个π键的分子是(写名称)乙烯
乙烯
.(3)H2O、NH3、CH4分子中键角由大到小的顺序为
CH4>NH3>H2O
CH4>NH3>H2O
,原因是由于氨气分子中含有一个孤电子对,水分子中含有2个孤电子对,对成键电子对的排斥作用增大,故键角逐渐减小
由于氨气分子中含有一个孤电子对,水分子中含有2个孤电子对,对成键电子对的排斥作用增大,故键角逐渐减小
.(4)由于电荷的作用,阴、阳离子形成化合物时离子的电子云会发生变化,使离子键逐渐向共价键过渡.阳离子电荷数越大、阴离子半径越大时,电子云变化越大,导致所形成的化合物在水中的溶解度越小.据此,四种卤化银在水中的溶解度由大到小的顺序为
AgF>AgCl>AgBr>AgI
AgF>AgCl>AgBr>AgI
.下列与有机物的结构、性质有关的叙述,正确的是( )
| A、苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | B、石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 | C、丙烯分子中所有原子不可能在同一平面上 | D、淀粉、纤维素都是天然高分子有机物,其链节中都含有葡萄糖 |